
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl _______P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________。(填“<”、“>”“=”)

②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________100℃时该反应的平衡常数K =_________。反应达到平衡的标志是:_____________。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
【答案】CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH = –442.8 kJ·mol – 1 < KC> KB >KA 0.003mol/L·min 2.25×10– 4 CD B
【解析】
根据盖斯定律分析热化学方程式的书写和热量的计算,根据平衡的三段式计算平衡时的数据和平衡常数、速率等,根据条件对平衡的影响进行分析。
(1)根据盖斯定律分析,热化学方程式 ①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1,②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1,③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1分析,有(①-②+③×4)/2得热化学方程式 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH =(-1275.6+566-44×4)kJ/mol/2= –442.8 kJ·mol – 1;
(2) ①温度不变,随着压强增大,平衡逆向移动,甲烷的平衡转化率减小,所以P1<P2;
随着温度升高,平衡转化率增大,说明平衡常数变大,所以平衡常数的关系为KC> KB >KA ;
②甲烷的消耗量为0.5mol,则根据方程式分析生成1.5mol氢气,则氢气表示反应速率为=![]() mol/(L·min)=0.003mol/(L·min);
mol/(L·min)=0.003mol/(L·min);
CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
起始物质的量1 2 0 0
改变物质的量0.5 0.5 0.5 1.5
平衡物质的量0.5 1.5 0.5 1.5
平衡常数为 =2.25×10–4;
=2.25×10–4;
A.该反应全为气体,容器的体积不变,所以容器内气体密度始终不变,所以密度恒定不能说明反应达到平衡,故错误;B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2 都表示正反应速率,不能说明反应达到平衡,故错误;C.容器的压强恒定可以说明反应体系中气体总物质的量不变,说明反应达到平衡,故正确;D.3v正(CH4)= v逆(H2)可以说明正逆反应速率相等,则能说明反应到平衡,故选CD。
③A.升高温度平衡正向移动,体系中气体物质的量增加,故错误;B.缩小容器体积,反应速率加快,平衡逆向移动,气体物质的量减小,故正确;C.再充入CH4气体,反应速率增加,平衡正向移动,气体物质的量增加,故错误;D.使用合适的催化剂,反应速率加快,但平衡不移动气体物质的量不变,故错误。故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是
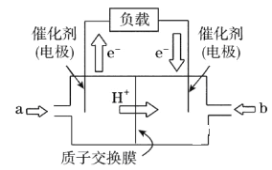
A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为CH3OH+H2O6e===CO2+6H+
D. 电池的正极反应式为O2+2H2O+4e===4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0℃、1.01×105Pa下,有关H2、O2、CH4三种气体的叙述正确的是
A.等体积的三种气体,其物质的量之比等于相对分子质量之比
B.三种气体的密度之比等于摩尔质量之比
C.等质量的三种气体,其体积比等于相对分子质量之比
D.等体积、等密度的三种气体物质的量之比等于相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的有( )
①NH4I的电子式:![]() ②8个中子的碳原子的核素符号:146C③碘酒、淀粉、水雾、纳米材料均为胶体④烧碱、冰醋酸、氯仿、胆矾均为电解质 ⑤用托盘天平称取8.75g食盐⑥用酸式滴定管量取23.22mL高锰酸钾溶液 ⑦C60、C70、金刚石、石墨均为碳的同素异形体⑧X射线、质谱、核磁共振属于现代化学对物质结构进行研究的手段
②8个中子的碳原子的核素符号:146C③碘酒、淀粉、水雾、纳米材料均为胶体④烧碱、冰醋酸、氯仿、胆矾均为电解质 ⑤用托盘天平称取8.75g食盐⑥用酸式滴定管量取23.22mL高锰酸钾溶液 ⑦C60、C70、金刚石、石墨均为碳的同素异形体⑧X射线、质谱、核磁共振属于现代化学对物质结构进行研究的手段
A. ②③④⑥⑦⑧B. ①③④⑥⑦C. ②⑥⑦⑧D. ②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为___g。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=__mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2mol·L-1 稀硫酸,计算需要量取____mL的浓硫酸。
(3)配平以下方程式___
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:___>__,每生成lmolCl2时有__个电子发生转移,氧化剂与还原剂的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol/L HCl溶液滴定未知浓度的氢氧化钠溶液,
(1)写出下列仪器名称
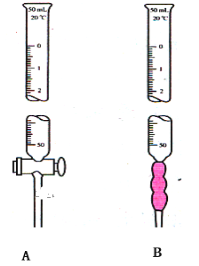
A________________。
B________________。
(2)操作可分解为如下几步:
①检查滴定管是否________________。
②用蒸馏水洗涤滴定管2~3次。
③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液________________2~3遍。
④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上________________处。
⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始_______________。
⑥取一定体积的待测液于锥形瓶中加入指示剂
⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是

甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠及其化合物的叙述错误的是( )
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.高压钠灯发出的黄光透雾能力强,可用于道路和广场照明
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和CO2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com