
| 酸 | Ka1 | Ka2 |
| H2C2O4 | 5.9×10-2 | 6.4×10-5 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2SO3 | 1.3×10-2 | 5.6×10-8 |
| HClO | 4.7×10-10 | |
| CH3COOH | 1.6×10-5 |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c2(H+) |
| 0.01 |
| 0.1×2×V1-0.1×V2 |
| V1+V2 |
| V1 |
| V2 |
| 11 |
| 19 |
| 0.1×19 |
| 11+19 |
| 0.1×11 |
| 11+19 |
| 11 |
| 19 |


科目:高中化学 来源: 题型:
| A、Be2+中的电子数和质子数之比一定为1:2 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
D、Cl-的结构示意图为: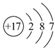 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4g铜粉与足量硫粉充分反应,失去的电子数为0.2NA |
| B、Na2O2与足量H2O反应生成0.2mol O2,转移电子的数目为0.4NA |
| C、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| D、0.5mol?L-1 CuCl2溶液中含有Cu2+数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
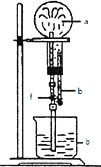 在图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
在图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )| A、NO和H2O |
| B、Cl2和饱和食盐水 |
| C、NH3和水 |
| D、NO2和H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com