
| A、1:2 | B、1:4 |
| C、大于1:4 | D、小于1:4 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
C、过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:3SO2+2NO3-+Ba2++2H2O═BaSO4↓+2NO↑+4H++2S
| ||
| D、常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种气体的质量相等 |
| B、三种气体的物质的量之比为16:2:1 |
| C、三种气体压强比为16:8:1 |
| D、三种气体体积为1:8:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
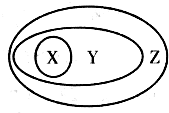
| X | Y | Z | |
| A | 硫酸 | 含氧酸 | 酸 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 化合物 | 纯净物 |
| D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①②③ | B、只有①②④ |
| C、只有②③④ | D、都存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L水中含有的水分子数是NA |
| B、0.10mol?L-1NaCl溶液中含有Cl-离子数是0.1NA |
| C、NA个O2分子的质量是16g |
| D、N=n?NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
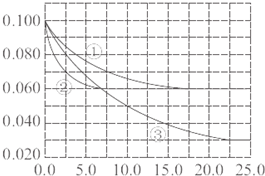 在一定温度下,将1molCO与3molH2气体充入一体积不变的密闭容器中,在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)
在一定温度下,将1molCO与3molH2气体充入一体积不变的密闭容器中,在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | 5 | ||
| ⅲ | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
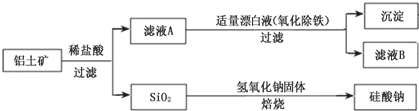
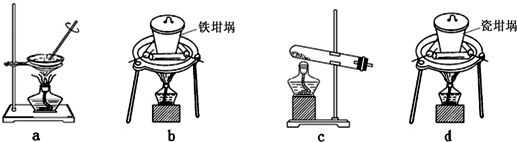
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com