
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
分析 n(e-)=$\frac{5C}{{1.6×{{10}^{-19}}C×6.02×{{10}^{23}}mo{l^{-1}}}}$=5.2×10-5 mol,正极反应MnO2~e-,根据二氧化锰和转移电子之间的关系式计算.
解答 解:n(e-)=$\frac{5C}{{1.6×{{10}^{-19}}C×6.02×{{10}^{23}}mo{l^{-1}}}}$=5.2×10-5 mol,正极反应MnO2~e-,则n(MnO2)=5.2×10-5 mol,m(MnO2)=5.2×10-5 mol×87g•mol-1=4.52×10-3g,故选C.
点评 本题以化学电源新型电池为载体考查关系式的有关计算,侧重考查分析计算能力,明确正极上发生的反应及各个物理量之间的关系式是解本题关键,注意电子物质的量的计算方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀指不纯金属接触到的电解质溶液进行化学反应而损耗的过程 | |
| B. | 电化腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程 | |
| C. | 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈 | |
| D. | 金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
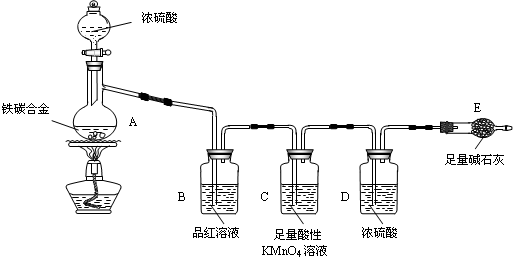
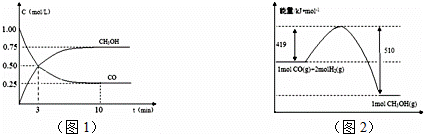
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
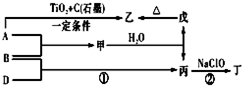 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去). .写出丙的结构式
.写出丙的结构式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取溶液进行焰色反应显黄色,一定含有Na+ | |
| B. | 滴加BaCl2溶液,产生白色沉淀,证明有SO42- | |
| C. | 滴加KSCN溶液,变为血红色,溶液中含Fe2+ | |
| D. | 加入稀盐酸产生无色气体,一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 只含有离子键的化合物才是离子化合物 | |
| C. | 并非只有非金属原子间才能形成共价键 | |
| D. | 由共价键形成的分子一定是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com