
| A. |  利用甘油密度大于乙醇且更易溶于水,进行甘油与乙醇的混合物分离 | |
| B. | 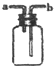 进行H2,NH3,CO2,Cl2,HCl,NO2等气体收集,也能用于NO气体收集 | |
| C. |  当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 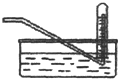 常用于实验室收集氧气、氢气等 |
分析 A.甘油与乙醇互溶;
B.与氧气反应的气体不能使用排空气法收集,a进气收集密度比空气小的气体,b进气收集密度比空气大的气体;
C.苯的密度比水小,不能隔绝气体与水;
D.氧气、氢气不溶于水,不与水反应.
解答 解:A.甘油与乙醇不分层,不能利用与中分液装置分离,故A错误;
B.与氧气反应的气体不能使用排空气法收集,a进气收集密度比空气小的气体,b进气收集密度比空气大的气体,则装置可进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集,故B错误;
C.苯的密度比水小,不能隔绝气体与水,则X为苯时不能防止倒吸,应选四氯化碳,故C错误;
D.氧气、氢气不溶于水,不与水反应,可用排水法收集,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、气体的收集及防倒吸装置等,把握物质的性质及反应原理为解答的关键,侧重分析与应用能力的考查,注意实验的评价性分析,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
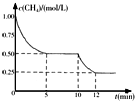 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 125.0克CuSO4•5H2O 晶体 | B. | 76.8克无水CuSO4 固体 | ||
| C. | 120.0克CuSO4•5H2O 晶体 | D. | 40.0克无水CuSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.4 g | B. | 11.6 g | C. | 8.8 g | D. | 3.2 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com