
| ĪļÖŹ | Al | Al2O3 | Fe | Fe2O3 |
| ČŪµć/”ę | 660 | 2054 | 1535 | 1462 |
| ·Šµć/”ę | 2467 | 2980 | 2750 | ------- |
| V £ØNaOH£©mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| m£Ø³Įµķ£©/g | 1.29 | 3.09 | 4.89 | 5.4 | 5.4 |
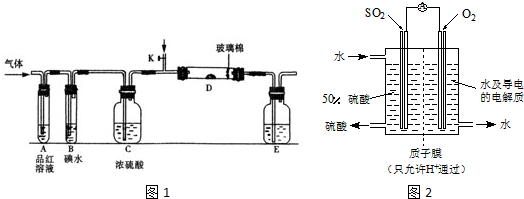
·ÖĪö £Ø1£©øł¾ŻĀĮŌŖĖŲµÄ»ÆŗĻ¼Ū±ä»ÆÅŠ¶ĻĀĮµÄŠŌÖŹ£»
£Ø2£©ĀĮÄÜŗĶĒæ¼ī·“Ӧɜ³ÉĘ«ĀĮĖįŃĪŗĶĒāĘų£¬¶ųĢś²»ÓėĒæ¼īČÜŅŗ·“Ó¦£»
£Ø3£©ĢśĄė×ÓÄܹ»ÓėĀĮ”¢Ģś·¢Éś·“Ӧɜ³ÉŃĒĢśĄė×Ó£¬øÉČÅĮĖĢśĄė×ӵļģŃ飻
£Ø4£©¢Ł°Ń7.47gČŪČŚĪļ£ØÖ÷ŅŖŗ¬ÓŠFeŗĶÉŁĮæFe2O3”¢A1£©Ķ¶Čė 140mL1.00mol•L-1Ļ”ĮņĖį£Ø×ćĮ棩³ä·Ö·“Ó¦£¬½«·“Ó¦ŗóµÄ»ģŗĻŅŗ·Ö³ÉĮ½µČ·Ż£¬ĻņĘäÖŠŅ»·ŻµĪ¼ÓKSCNČÜŅŗ£¬ČÜŅŗ²»±äÉ«£¬ĖµĆ÷ČÜŅŗÖŠĢśŌŖĖŲČ«²æĪŖŃĒĢśĄė×Ó£¬ĻņĮķŅ»·ŻÖŠµĪ¼Ó2.00mol•L-1µÄNaOHČÜŅŗ£¬µ±¼ÓČė2.5mLŹ±æŖŹ¼²śÉś³Įµķ£¬Ōņ2£¬5mlŹĒÖŠŗĶŹ£ÓąĮņ¾ĶĮņĖį£¬ĖęĒāŃõ»ÆÄĘ¼ÓČėŃĒĢśĄė×Ó”¢ĀĮĄė×ÓÉś³É³Įµķ£¬×ī“ó³ĮµķŹ±£¬ŅĄ¾ŻĮņĖįøłĄė×ÓŗĶÄĘĄė×ÓŹŲŗć¼ĘĖćĖłŠčĒāŃõ»ÆÄĘČÜŅŗĢå»ż£»
¢Ś·ÖĪöæÉÖŖ1.29g³ĮµķÖŠŗ¬ĒāŃõ»ÆĀĮŗĶĒāŃõ»ÆŃĒĢś³Įµķ£¬Éč1.29 g³ĮµķÖŠŗ¬A1£ØOH£©3x mol£¬Fe£ØOH£©2 y mol£¬
Ōņ78x+90y=1.29
2.5”Į10-3”Į2.00+3x+2y=20”Į10-3”Į2.00
ĮŠŹ½¼ĘĖćµĆµ½³ĮµķÖŹĮ森
½ā“š ½ā£ŗ£Ø1£©ĀĮČČ·“Ó¦ÖŠĀĮ×÷Ńõ»Æ¼Į£¬ĀĮŹ§µē×Ó»ÆŗĻ¼ŪÉżøß±»Ńõ»Æ£¬·“Ó¦ÖŠĢåĻÖ³öĘ仹ŌŠŌ£¬
¹Ź“š°øĪŖ£ŗŃõ»Æ£»
£Ø2£©ĀĮÄÜŗĶĒæ¼ī·“Ӧɜ³ÉŃĪŗĶĒāĘų£¬ĢśŗĶĒāŃõ»ÆÄĘČÜŅŗ²»·“Ó¦£¬ĖłŅŌŅŖŃéÖ¤ŗ¬ÓŠĀĮĖłŠčÓƵďŌ¼ĮĪŖĒāŃõ»ÆÄĘČÜŅŗ£¬¹Ū²ģµ½µÄĻÖĻóŹĒČÜŅŗÖŠÓŠĘųÅŻ³öĻÖ£¬
¹Ź“š°øĪŖ£ŗNaOHČÜŅŗ£»
£Ø3£©ÓÉÓŚĢśĄė×Ó¼ģŃéŃõ»ÆŠŌ£¬Äܹ»ÓėĢś”¢ĀĮ·¢Éś·“Ӧɜ³ÉŃĒĢśĄė×Ó£¬øÉČÅĮĖĢśĄė×ӵļģŃ飬ĖłŅŌøĆ·½·Ø²»ŗĻĄķ£¬
¹Ź“š°øĪŖ£ŗ²»ŗĻĄķ£»Fe3+Ņ×±»Fe”¢Al»¹Ō³ÉFe2+£»
£Ø4£©¢Łµ±³ĮµķĮæ×ī“óŹ±ÄĘĄė×ÓČ«²æ±ä»ÆĪŖĮņĖįÄĘ£¬½įŗĻŌŖĖŲŹŲŗć£¬
2NaOH”«H2SO4£¬
2 1
n 0 140L”Į1.00mol•L-1
n=0.28mol
Ćæ·ŻČÜŅŗČ«²æ³ĮµķŠčŅŖĒāŃõ»ÆÄĘĪļÖŹµÄĮæ=0.14mol£¬
³Įµķ×ī“óŠčŅŖĒāŃõ»ÆÄĘČÜŅŗĢå»ż=$\frac{0.14mol}{2mol/L}$=0.07L=70ml£¬
¹Ź“š°øĪŖ£ŗ70£»
¢Ś·ÖĪöæÉÖŖ1.29g³ĮµķÖŠŗ¬ĒāŃõ»ÆĀĮŗĶĒāŃõ»ÆŃĒĢś³Įµķ£¬Éč1.29 g³ĮµķÖŠŗ¬A1£ØOH£©3x mol£¬Fe£ØOH£©2 y mol£¬
Ōņ78x+90y=1.29
2.5”Į10-3”Į2.00+3x+2y=20”Į10-3”Į2.00
½āµĆ£ŗx=0.005£¬y=0.01
ĖłŅŌAl£ØOH£©3µÄÖŹĮæĪŖ0.005mol”Į78g/mool=0.39 g£¬
Fe£ØOH£©2µÄÖŹĮæĪŖ0.01mol”Į90g/mol-=0.9 g£¬
“š£ŗAl£ØOH£©3µÄÖŹĮæ0.39 g£¬Fe£ØOH£©2µÄÖŹĮæĪŖ0.9 g£®
µćĘĄ ±¾Ģāæ¼²éĮĖĀĮČČ·“Ó¦ŌĄķ”¢»Æѧ·½³ĢŹ½µÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕĀĮČČ·“Ó¦ŌĄķ£¬Ć÷Č·øł¾Ż»Æѧ·½³ĢŹ½½ųŠŠ»Æѧ¼ĘĖćµÄ·½·Ø£¬£Ø4£©ĪŖÄŃµć”¢Ņדķµć£¬×¢ŅāŗĻĄķ·ÖĪöÖŹĮæ±ä»Æ¼°·¢ÉśµÄ·“Ó¦£¬ŌŖĖŲŹŲŗćŗĶ·“Ó¦¶ØĮæ¹ŲĻµµÄ¼ĘĖćŹĒ½āĢā¹Ų¼ü£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | FeÓėĻ”ŃĪĖį·“Ó¦£ŗFe+2H+ØTFe3++H2”ü | |
| B£® | ŃĪĖįÓėNaOHČÜŅŗ·“Ó¦£ŗH++OH-ØTH2O | |
| C£® | CaCO3ÓėĻ”HNO3·“Ó¦£ŗCaCO3+2H+ØTCa2++CO2”ü+H2O | |
| D£® | BaCl2ČÜŅŗÓėNa2SO4ČÜŅŗ·“Ó¦£ŗBa2++SO42-ØTBaSO4”ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H+”¢Na+”¢C1-”¢NO3- | B£® | K+”¢Ag+”¢C1-”¢NO3- | ||
| C£® | H+”¢Na+”¢CO32-”¢SO42- | D£® | H+”¢Fe2+”¢C1-”¢OH- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČōAĪŖÅØ°±Ė®£¬BĪŖÉśŹÆ»Ņ£¬CÖŠŹ¢AlCl3ČÜŅŗ£¬ŌņCÖŠĻČ²śÉś°×É«³Įµķŗó³ĮµķÓÖČܽā | |
| B£® | ČōAĪŖÅØŃĪĖį£¬BĪŖKMnO4£¬CÖŠŹ¢Ę·ŗģČÜŅŗ£¬ŌņCÖŠČÜŅŗĶŹÉ« | |
| C£® | ČōAĪŖÅØH2SO4£¬BĪŖCu£¬CÖŠŹ¢ÓŠ³ĪĒåŹÆ»ŅĖ®£¬ŌņCÖŠČÜŅŗ±ä»ė×Ē | |
| D£® | ČōAĪŖÅØH2SO4£¬BĪŖNa2SO3¹ĢĢ壬CÖŠŹ¢ŹÆČļŹŌŅŗ£¬ŌņCÖŠČÜŅŗĻȱäŗģŗóĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
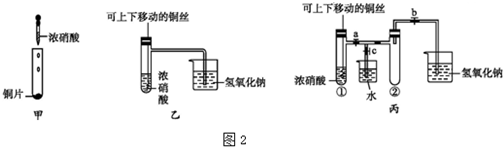
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{22.4ac}{M?1-c?}$ L | B£® | $\frac{22.4c}{M}$ L | ||
| C£® | $\frac{22.4ac}{1000b-Mc}$ L | D£® | $\frac{22.4ac}{1000b}$ L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
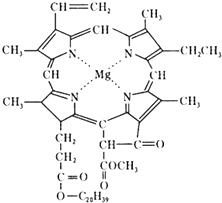 ĪŅ¹śæĘѧ¹¤×÷ÕßŗĻ³ÉĮĖŠķ¶ą½į¹¹ø“ŌÓµÄĢģȻӊ»ś»ÆŗĻĪļ£¬Čē£ŗŅ¶ĀĢĖŲ”¢ŃŖŗģĖŲ”¢Ī¬ÉśĖŲBµČ£¬Ņ¶ĀĢĖŲµÄ½į¹¹ČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ĪŅ¹śæĘѧ¹¤×÷ÕßŗĻ³ÉĮĖŠķ¶ą½į¹¹ø“ŌÓµÄĢģȻӊ»ś»ÆŗĻĪļ£¬Čē£ŗŅ¶ĀĢĖŲ”¢ŃŖŗģĖŲ”¢Ī¬ÉśĖŲBµČ£¬Ņ¶ĀĢĖŲµÄ½į¹¹ČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | Ņ¶ĀĢĖŲŹōÓŚøß·Ö×Ó»ÆŗĻĪļ | |
| B£® | Ņ¶ĀĢĖŲ·Ö×ÓÖŠŗ¬ÓŠĮ½ÖÖĄąŠĶµÄĖ«¼ü | |
| C£® | Ņ¶ĀĢĖŲ²»ŹōÓŚ·¼ĻćĢž | |
| D£® | ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ņ¶ĀĢĖŲÄܼӳɔ¢Ė®½ā”¢õ„»ÆµČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com