
下列有关图示分析正确的是
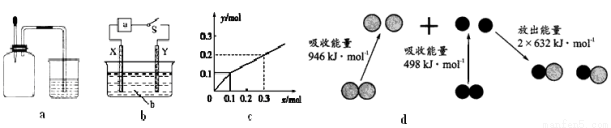
A.如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶
B.如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a
C.Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D.图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=—180 kJ/mol
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和 为24。则下列判断正确的是
| T | |
X | Y | Z |
A.R位于元素周期表中第二周期第VIA族
B.五种元素中原子序数最大的是X
C.气态氢化物稳定性:T>Y
D.Z元素的最高价氧化物对应的水化物的化学式为H2ZO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol Na2O2与水反应转移电子数目为0.1 NA
B.标况下,2. 24 L Cl2含孤电子对的数目为0.2NA
C.pH =2的H2SO4洛液中含H+的数目为0.1 NA
D.在l0g质量分数为17%的氨水中,含有H的数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:简答题
(14分)一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
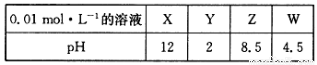

将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
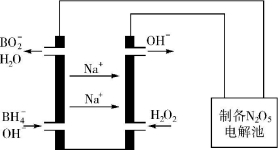 (5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:填空题
(15分)A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2 ,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)

(1)根据分子结构模型写出A的结构简式 .
(2)A在酸性条件下水解生成有机物B和甲醇,与B互为同分异构体的C: 含苯环,能发生银镜反应,且苯环上只有一个支链.则C的结构简式为(任写二种) 、 .
(3)拟以芳香烃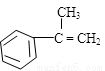 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:

(i)写出反应类型:反应①属____________反应,反应⑤属____________反应.
(ii)写出结构简式:D_________________ H_____________________.
(iii)已知F分子中含“-CH2OH ”,通过F不能有效、顺利地获得B,其原因是:___________.
(iv)写出反应⑥方程式(注明必要的反应条件)_________________________________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是
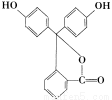
A.酚酞的分子式为C20H14O4
B.酚酞可与FeCl3溶液发生显色反应
C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2
D.1 mol酚酞与NaOH溶液共热,最多可消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:简答题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为 ;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol/L氨水中滴加0.l mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-a mol/L
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A.①④ B.②④ C.①③ D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com