

分析 硼镁矿与氢氧化钠溶液反应:Mg2B2O5•H2O+2NaOH═2NaBO2+2Mg(OH)2,过滤除去氢氧化镁,NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O7•10H2O与为NaHCO3,过滤分离,由于硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,故Na2B4O7•10H2O晶体与硫酸反应得到硼酸,溶液b中含有硫酸钠,硼酸晶体加热分解得到B2O3,最后用Mg还原得到粗硼,
(1)步骤①为Mg2B2O5.H2O与氢氧化钠溶液反应生成NaBO2与Mg(OH)2;
(2)NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O7•10H2O与为NaHCO3;
(3)溶液a为碳酸氢钠溶液,物料手恒其中c(Na)=c(C),C元素在CO32-、HCO3-、H2CO3中;
(4)根据强酸制弱酸分析;
(5)①根据淀粉与碘单质显示蓝色判断;根据反应结束后溶液的蓝色消失分析;
②根据反应方程式及滴定数据计算出粗硼中硼的含量;
(6)根据各元素物质的量比以及图中各数据计算出各元素的原子个数比,写出化学式.
解答 解:(1)步骤①为Mg2B2O5.H2O与氢氧化钠溶液反应生成NaBO2与Mg(OH)2,反应方程式为:Mg2B2O5•H2O+2NaOH=2NaBO2+2Mg(OH)2;
故答案为:Mg2B2O5•H2O+2NaOH═2NaBO2+2Mg(OH)2;
(2)NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O7•10H2O与为NaHCO3,离子方程式为:2Na++4BO2-+2CO2+11H2O═Na2B4O7•10H2O↓+2HCO3-;
故答案为:2Na++4BO2-+2CO2+11H2O═Na2B4O7•10H2O↓+2HCO3-;
(3)溶液a为碳酸氢钠溶液,物料手恒其中c(Na)=c(C),则c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);
故答案为:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);
(4)由于硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,故Na2B4O7•10H2O晶体与硫酸反应得到硼酸;
故答案为:利用强酸制备弱酸H3BO3;
(5)①滴定过程中有碘单质参与,可以使用淀粉溶液作为指示剂,滴定终点时溶液由蓝色恰好变为无色;
故答案为:淀粉溶液;溶液由蓝色恰好变为无色;
②硫代硫酸钠的物质的量为:2mol/L×0.0270L=0.0540mol,根据关系式:B~BI3~$\frac{3}{2}$I2~3S2O32-,n(B)=$\frac{1}{3}$n(S2O32-)=0.0180mol,
硼的质量为:11g/mol×0.0180mol=0.198g,粗硼中硼的含量为:$\frac{0.198g}{0.25g}$×100%=79.2%;
故答案为:79.2%;
(6)T3时,n(Na)=$\frac{20.0g×23%}{23g/mol}$=0.2mol
则30.8g样品中,根据n(Na):n(B):n(H):n(O)=1:1:n:7=0.2:0.2:0.2n:1.4,
样品的质量为:0.2×23+0.2×11+0.2n+1.4×16=30.8
解得:n=8,则原晶体为:NaBO3•4H2O.
T3时所得晶体中钠元素的质量分数,求出结晶水数目:$\frac{23}{23+11+48+18n}$=0.23,解得n=1,
所以T3时所得晶体的化学式为NaBO3•H2O;
故答案为:NaBO3•H2O;
解:T3时n(Na)=$\frac{20.0g×23%}{23g/mol}$=0.2mol,
则30.80 g样品中,依n(Na):n(B):n(H):n(O)=l:1:n:7=0.2:0.2:0.2n:1.4,
样品的质量为:0.2×23+0.2×11+0.2n+1.4×16=30.8
解得:n=8,则原晶体为:NaBO3•4H2O.
T3时所得晶体中钠元素的质量分数,求出结晶水数目:$\frac{23}{23+11+48+18n}$=0.23,解得n=1,
所以T3时所得晶体的化学式为NaBO3•H2O.
点评 本题考查化学制备方案,图象分析判断和计算应用,理解工艺流程原理是解题关键,侧重对化学用语的考查,需要学生具备扎实的基础与灵活运用的能力,难度中等.


科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1
(2)C(s)+O2(g)=CO2(g)△H2
(3)2H2(g)+O2(g)=2H2O(l)△H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l)△H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H5
下列关于上述反应的焓变的判断正确的是( )
A.△H1>0,△H2<0 B.△H5=2△H2+△H3﹣△H1
C.△H3>0,△H5<0 D.△H4=△H1﹣2△H3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
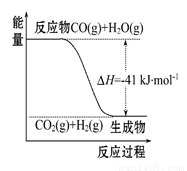
①反应的热化学方程式为 。
②已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131 kJ·mol-1,
则C(s)+CO2(g)=2CO(g) ΔH= 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391
mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391 .55 kJ·mol-1。则N
.55 kJ·mol-1。则N 2(g)+3H2(g)=2NH3(g) ΔH= 。
2(g)+3H2(g)=2NH3(g) ΔH= 。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:

(1)甲池是 装置,乙装置中电极A的名称 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中电极B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH= 。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
随着人们生活质量的提高,废电池需集中处理的问题被提到议事日程,主要原因是
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用VA、VB、VC表示,已知2VB=3VA、3 VC =2 VB,则此反应可表示为( )
A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应可区分胶体和溶液 | |
| B. | 煤可经分馏获得洁净的燃料 | |
| C. | 非金属材料中不可以含有金属元素 | |
| D. | 电解氯化镁饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32:18 | B. | 16:11 | C. | 8:11 | D. | 16:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com