
| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
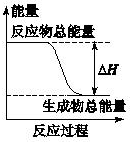
分析 从图上分析,反应物能量高于生成物,正反应是放热反应.
常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、多数的化合反应等.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等.
解答 解:A.活泼金属与酸的反应是放热反应,故A正确;
B.灼热的碳和二氧化碳的反应,是以C作为还原剂的反应,反应吸热,故B错误;
C.Ba(OH)2•8H2O与NH4Cl晶体混合反应是吸热反应,故C错误;
D.碳酸钙分解属于分解反应,是吸热反应,故D错误.
故选A.
点评 本题通过反应物与生成物能量不同判断放热反应和吸热反应,熟悉常见的放热反应和吸热反应是解题的关键,题目难度不大.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
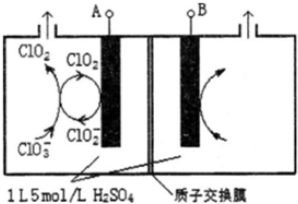 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的同分异构体中,一氯代物仅有一种的有机物一定是2,2一二甲基戊烷. | |
| B. | 若某高分子化合物对应的单体有两种,则此高聚物一定是通过缩聚反应得到的. | |
| C. | 等物质的量的乙烯和乙醇在足量氧气中完全燃烧,消耗O2和生成CO2的量相等 | |
| D. | 苯丙氨酸的结构为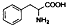 ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列反应属于吸热反应的是DE
(1)下列反应属于吸热反应的是DE查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com