
| A、铜与热的浓H2SO4反应放出1 mol气体时转移的电子数为2NA |
| B、1mol冰中含有的氢键数目为NA |
| C、标准状况下,22.4 L CCl4含有的分子数为NA |
| D、1 mol羟基含有的电子数为7NA |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
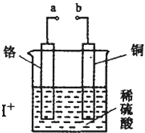 如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )
如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )| A、铜的金属性比铬强 |
| B、总反应为Cu+H2SO4═CuSO4+H2↑ |
| C、溶液中SO42-向铬极移动 |
| D、若将a接电源负极、b接电源正极,铜极反应为2H2O-4e-═O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na202晶体中阳离子和阴离子的总个数为0.4NA | ||
| B、标准状况下,1.12 LHCH0所含的原子总数是0.2NA | ||
C、agO2和O3的混合气体中所含的分子数一定为(
| ||
| D、3.2g铜与一定量的浓硝酸完全反应生成的气体分子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-221 kJ/mol |
| B、-110.5 kJ/mol |
| C、+110.5 kJ/mol |
| D、+221 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)mol?L-1 | c(CO2)mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、碳酸钠的水解反应:CO
| ||
| B、稀硝酸和过量的铁屑反应:Fe+4H++NO3═Fe3++NO↑+2H2O | ||
C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO
| ||
D、碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的c(H+)=1×10-14mol/L的溶液:K+、AlO2-、Br-、Cl- |
| B、在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+ |
| C、在c(H+)=1×10-13 mol?L-1的溶液中:Na+、S2-、SO32-、NO3- |
| D、在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=1 |
| B、2min内A的反应速率为0.3 mol?(L?min)-1 |
| C、B的转化率为40% |
| D、若混合气体的密度不变则表明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气:Na+、Ba2+、I-、HSO3- |
| B、二氧化碳:K+、Na+、SiO32-、Cl- |
| C、氨气:Ag+、Al3+、Na+、NO3- |
| D、氯化氢:Ca2+、Fe3+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com