
分析 (1)氯气与石灰乳制备漂粉,漂白粉在空气中与二氧化碳、水反应生成HClO可变质;
(2)pH试纸先变蓝(约为12)后褪色,则溶液具有碱性、漂白性;利用电子转移计算消毒效率;
(3)SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去,黄绿色气体为氯气,白色沉淀为硫酸钙,
①溶液酸性的增强,漂白粉的有效成分和C1-发生反应,则需要加酸;
②氯气与二氧化硫反应;
③SO2与漂白粉的有效成分在酸性条件下,发生氧化还原反应.
解答 解:(1)利用氢氧化钙和氯气发生反应生成次氯酸钙、氯化钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉在空气中与二氧化碳、水反应生成HClO可变质,发生的反应为Ca(ClO)2+CO2+H2O=CaCO3+2HClO,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3+2HClO;
(2)pH试纸先变蓝(约为12)后褪色,则溶液具有碱性、漂白性;ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的$\frac{1mol×[4-(-1)]}{1mol×2×[0-(-1)]}$=2.5倍,故答案为:碱性和漂白性;2.5;
(3)SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去,黄绿色气体为氯气,白色沉淀为硫酸钙,
①进一步实验确认了这种可能性,其实验方案是向漂白粉溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色,
故答案为:向漂白粉溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
②用离子方程式解释现象中黄绿色褪去的原因为Cl2+SO2+2H2O=4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O=4H++2Cl-+SO42-;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式为2SO2+Ca2++2ClO-+2H2O=4H++2Cl-+CaSO4↓+SO42-,故答案为:2SO2+Ca2++2ClO-+2H2O=4H++2Cl-+CaSO4↓+SO42-.
点评 本题考查二氧化硫和氯气的化学性质,为高频考点,综合考查元素化合物知识,把握物质的性质、实验设计及现象与结论的关系为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③正确 | B. | 都不正确 | ||
| C. | ⑥⑦正确,其它不正确 | D. | 仅③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
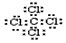 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 横线中的物质是Cu2S | B. | CuFeS2仅作还原剂 | ||
| C. | SO2是还原产物,不是氧化产物 | D. | FeS是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的非金属元素都分布在p区 | |
| B. | 元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| D. | 第ⅠA、ⅡA族元素的原子,其半径越大,电负性越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com