
| 5 |
| 6 |

| 转化量 |
| 起始量 |
| 转化量 |
| 起始量 |
| 0.5 |
| 1 |
| 5 |
| 6 |
| 5 |
| 6 |
| n(C) |
| 2 |
| n(C) |
| 2 |
| n(C) |
| 2 |
| n(C) |
| 2 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ |
| B、向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+═BaSO4↓ |
| C、向稀硫酸溶液中加铁:2Fe+6H+═2Fe3++3H2↑ |
| D、碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=2,n=1 |
| B、m=1,n=3 |
| C、m=1,n=2 |
| D、m=3n=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 200 | 300 | 400 |
| k | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)?CH3OH(g)+、H2O(g)△H1 回答下列问题.
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)?CH3OH(g)+、H2O(g)△H1 回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
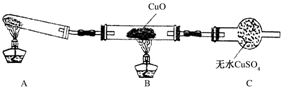
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X+2Z→3Y |
| B、X+Z→2Y |
| C、3X→Y+Z |
| D、X→Y+3Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
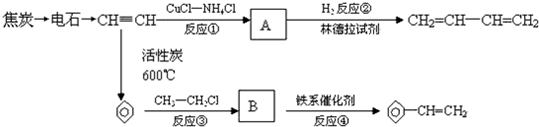
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com