
| A. | 核电荷数 | B. | 质子数 | C. | 中子数 | D. | 电子数 |
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
为了配制100mL1mol/L的NaOH溶液,其中有下列几个操作,错误的是( )
①NaOH用称量纸盛装进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH在烧杯里刚完全溶解时,立即将溶液转移到容量瓶;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切.
A.①③ B.①③⑤ C.②③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
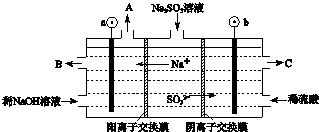
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液 | 溶液紫红色褪去 | 含有Fe2+(或溶液紫红色不褪去,不含Fe2+) |
| 步骤②:另取少量所得溶液,滴加KI-淀粉溶液 | 含有Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图装置: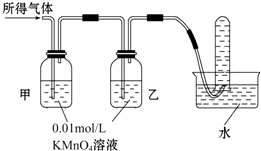 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
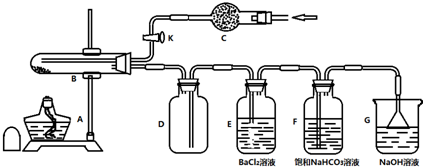
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 1.50 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 19.85 | 20.22 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| B. | NA个Fe(OH)3胶体粒子的质量为107g | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com