



 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
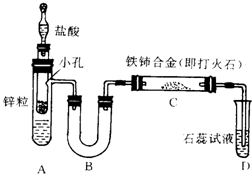 已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水.有人设计以下装置(A中盛有饱和NaNO2与NH4Cl的混合溶液)来进行有关实验.
已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水.有人设计以下装置(A中盛有饱和NaNO2与NH4Cl的混合溶液)来进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液操作时,若要回收上层液体,应先从上口倒出上层液体,再从下口将下层液体放出 |
| B、浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 |
| C、AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 |
| D、检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究硫及其化合物的性质具有重要意义.
研究硫及其化合物的性质具有重要意义.| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、NaHSO3、Na2SO3 | SO3、X、NaHSO4、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B、酸碱中和滴定时用待测液润洗锥形瓶,所测结果偏高 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测最高温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④ |
| C、①②③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、SO42-、NO3-、Fe(OH)3胶体微粒 |
| B、b点对应的溶液中:Al3+、H+、MnO4-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com