
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为( )
A. 1∶1 B. 1∶2 C. 1∶10 D. 1∶20
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:
分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 500g·L-1 |
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:
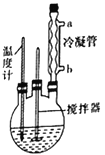
(1)控制反应温度的适宜方法是__________ (填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热
(2)反应器中发生反应的化学方程式为___________________________________。
(3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________。
(4)搅拌器不能选择铁质或铝质材料的原因是_______________________________________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
实验序号 | 1 | 2 | 3 | |
KMnO4溶液体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
滴定后读数 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液应盛放在__________滴定管中,滴定终点的现象是_____________。
②产品中活性氧的质量分数为____________。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量__________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰化钾(KSCN)是重要的化学试剂和药品。它易溶于水,水溶液呈中性。
完成下列填空:
(1)钾离子的电子式为______。碳原子的电子排布式为______;C和N的原子半径大小比较为C______N(填“>”、“=”或“<”)。
(2)如图装置所示是KSCN溶于水时的实验现象,该现象说明KSCN溶于水时会____(填“吸收”或“放出”)热量,则该溶解过程水合的热效应______(填“>”、“=”或“<”)扩散的热效应。

(3)KSCN水溶液呈中性,则硫氰酸(HSCN)的电离方程式为__________________;硫氰化铵(NH4SCN)溶液中各种离子浓度由大到小的顺序是______________。
(4)若用KSCN溶液检验氯化亚铁溶液是否变质,实验方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。

(1)制备无水AlCl:
实验装置如下。已知AlCl3178℃升华,在潮湿的空气中易水解。

①实验时应先点燃_______(填“A”或“D”)处酒精灯,当观察到_______时,再点燃另一处酒精灯。
②装置F的作用是_________________。
(2)制取铝氢化钠
制取铝氢化钠的化学方程式是_________________,AlCl3配成有机溶液的目的是__________。
(3)铝氢化钠样品性质探究和纯度测定
①称取一定质量实验制得的铝氢化钠样品(除含产物杂质外,还可能含有过量的NaH),滴加足量的水,观察到产生气体,该气体是________________。
②向反应后的溶液中滴加酚酞,溶液变红。猜想可能是生成了NaOH呈碱性,也可能
是_________________。为验证猜想,可再逐滴滴加盐酸并振荡,当观察到____________时,即可证明两种猜想均成立。
③设计如下两种装置测定生成气体的体积(若其他操作一致),用甲装置测得铝氢化钠的含量________乙装置。(填“大于”、“小于”或“等于”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H和3H都是制造氢弹的原料。下列关于2H和3H的说法正确的是
A.2H和3H的质子数不同B.2H和3H互为同位素
C.2H和3H是同一种核素D.3H原子的电子数为3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g)反应中,已知v (HCN)=n mol/(Lmin),且v(O2)=m mol/(Lmin),则m与n的关系正确的是( )
A.m= ![]() n
n
B.m= ![]() n
n
C.m= ![]() n
n
D.m=2n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 联氨(N2H4)中含有极性键和非极性键
C. 过程II属于氧化反应,过程IV属于还原反应
D. 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com