
【题目】今有室温下有四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
A.分别加水稀释10倍,四种溶液的pH①>②>④>③
B.①加入适量的氯化铵晶体后,溶液的pH减小
C.①溶液中c(NH4+)+c(H+)大于④中的c(Cl﹣)+c(OH﹣)
D.VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9
【答案】C
【解析】解:A.酸稀释10倍后仍然是酸、碱稀释10倍后仍然是碱,加水稀释促进弱电解质电离,所以分别稀释10倍后,醋酸的pH<强酸、弱碱的pH>强碱,所以稀释后pH①>②>④>③,故A正确;B.①中加入适量氯化铵晶体,铵根离子浓度增大,抑制一水合氨电离,则溶液中c(OH﹣)减小,溶液的pH减小,故B正确;
C.根据电荷守恒知,①溶液中c(NH4+)+c(H+)=c(OH﹣)、④中的c(Cl﹣)+c(OH﹣)=c(H+),①溶液中c(OH﹣)= ![]() mol/L=10﹣3 mol/L、④中的c(Cl﹣)+c(OH﹣)=c(H+)=10﹣3 mol/L,所以①溶液中c(NH4+)+c(H+)等于④中的c(Cl﹣)+c(OH﹣),故C错误;
mol/L=10﹣3 mol/L、④中的c(Cl﹣)+c(OH﹣)=c(H+)=10﹣3 mol/L,所以①溶液中c(NH4+)+c(H+)等于④中的c(Cl﹣)+c(OH﹣),故C错误;
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则 ![]() mol/L=10﹣4 mol/L,
mol/L=10﹣4 mol/L,
则Va:Vb=11:9,故D正确;
故选C.


科目:高中化学 来源: 题型:
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下3种试剂:A.饱和食盐水 B.NaOH溶液 C.浓硫酸
请在以上试剂中选择填空:
①X、Y溶液分别应选用______(填“A”、“B”或“C”)、
②尾气处理过程中,多余的氯气可用______(填“A”、“B”或“C”)吸收。
(2)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。

①写出Cl2与水反应的离子方程式______。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是______。
(3)如图所示,上述实验过程中,不会产生气体的是______,写出反应A的化学方程式______。

(4)碘是人体中不可缺少的微量元素,碘缺乏病是目前已知的导致人类智力障碍的主要原因,我国在食盐中加入碘元素能有效防止缺碘引起的疾病。

某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
甲.加入萃取剂后振荡乙.静置分层丙.分离
①该同学所采用的萃取剂可能是______(填“A”、“B”或“C”)。
A.酒精 B.苯C.四氯化碳
②甲、乙、丙3步实验操作中,不正确的是______(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1.B为常见液体.

试回答下列问题:
(1)X是______;F是______.
(2)A→D反应中每消耗1摩过氧化钠转移的电子数为______.
(3)G与Cu的反应中,G表现______性质.
(4)X与过量NaOH溶液反应的离子方程式:______.
(5)以C、B、D为原料可生产G,若使1molC完全转化为G,理论上至少需要D______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,发生反应2SO3(g)2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: 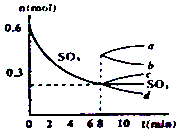
(1)用O2表示0~8min内该反应的平均速率v= .
(2)升高温度,K值将;容器中气体的平均相对分子质量将 . (填“增大”“减小”或“不变”)
(3)能说明该反应已达到平衡状态的是
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)从8min起,压缩容器为1L,则SO3的变化曲线为
A.a
B.b
C.c
D.d.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、IV四步中对于溶液和沉淀的分离采取的方法是_________;获得沉淀后,要对沉淀进行洗涤,请简述洗涤沉淀的操作是______________________________________。
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式并回答相关问题:
固体B_______;溶液液E_______;沉淀D的重要用途是__________________;KAl(SO4)2的重要用途是_____________________________。
(3)写出写出①、②、③三个反应的离子方程式:①______;②______;③______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283 kJmol﹣1
O2(g)═CO2(g)△H=﹣283 kJmol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJmol﹣1
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJmol﹣1
D.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确( )
A. 可用pH试纸测新制氯水的pH
B. 工业上将氯气通入澄清石灰水制漂白粉,其有效成分是次氯酸钙
C. 漂白粉漂白时,向溶液中滴入少量稀盐酸或通入二氧化碳可以增强漂白效果
D. FeCl2既能由金属和氯气直接反应得到,又能由金属和盐酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com