
分析 无色溶液中不存在有色的Fe3+离子,
①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②0.04mol为氨气,溶液中一定含有NH4+,并且物质的量为0.04mol;
③2.33g为硫酸钡,6.27g为硫酸钡和碳酸钡,根据n=$\frac{n}{M}$计算出沉淀的物质的量;
再根据电荷守恒,得出是否存在钾离子,以此来解答.
解答 解:无色混合物的水溶液中一定不存在Fe3+离子,
①与AgNO3溶液有沉淀产生的离子有:Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生气体,该气体为氨气,故原溶液中一定有0.04mol铵离子;
③不溶于盐酸的2.33g为硫酸钡,物质的量为$\frac{2.33g}{233g/mol}$=0.01mol;6.27g沉淀是硫酸钡和碳酸钡的混合物,碳酸钡质量为:6.27g-2.33g=3.94g,物质的量为$\frac{3.94g}{197g/mol}$=0.02mol,故原溶液中一定存在CO32-、SO42-,根据离子共存,则一定没有Mg2+,
根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol,c(-)=2c(CO32-)+2c(SO42-)=0.06mol,总正电荷小于负电荷,则原溶液中一定含有K+,至少为0.02mol;
综上所述,一定存在的离子有NH4+、K+、CO32-、SO42-,一定不存在的离子为:Fe3+、Mg2+,可能存在Cl-,
(1)溶液中可能存在的离子是Cl-,肯定不存在的离子是Fe3+、Mg2+,故答案为:Cl-;Fe3+、Mg2+;
(2)由上述电荷守恒可知,K+≥0.02mol,故答案为:K+≥0.02mol;
(3)检验可能存在的离子,操作为取适量原溶液先加足量稀硝酸,再加过量硝酸钡并过滤,最后再加硝酸银若仍有不溶于稀硝酸沉淀生成,则存在Cl-,
故答案为:取适量原溶液先加足量稀硝酸,再加过量硝酸钡并过滤,最后再加硝酸银若仍有不溶于稀硝酸沉淀生成,则存在Cl-.
点评 本题考查常见离子的推断,为高频考点,把握发生的反应、离子推断及计算为解答的关键,侧重分析与实验能力的考查,注意电荷守恒的应用,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用湿润的淀粉碘化钾试纸检验是否有Cl- | |
| B. | 用托盘天平称取12.6g Na2SO4固体粉末 | |
| C. | 通过分液方法分离酒精和水 | |
| D. | 将250g Cu2SO4•5H2O固体溶于1L水,配制1 mol•L-1 CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
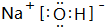 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g 2H2O所含中子总数为NA | |
| B. | 1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 反应KIO3+6HI═KI+3H2O+3I2中,生成1mol I2转移电子的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用石斧解剖 | B. |  早期的农业耕作 | C. |  简单机械织布 | D. |  祥云火炬燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO5•5H2O的质量 | |
| B. | 纯水在25℃和90℃时的pH值 | |
| C. | 25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 | |
| D. | 在反应NH3+NO→N2+H2O中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的单质能够用来制造光导纤维 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com