
| A. | 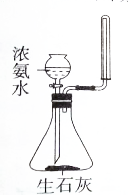 制取少量氨气 | B. | 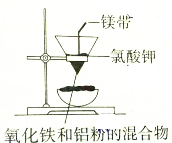 可制的金属铁 | ||
| C. |  制乙酸乙酯 | D. | 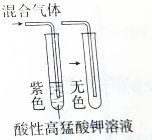 验证混合气体中一定含有乙烯 |
分析 A.浓氨水与CaO反应生成氨气,收集氨气利用向下排空气法;
B.氧化铁与Al反应生成氧化铝和Fe,点燃镁条引发铝热反应;
C.乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,饱和碳酸钠除去乙酸、乙醇、与乙酸乙酯分层;
D.能使高锰酸钾褪色的气体具有还原性,可能为乙烯、二氧化硫等.
解答 解:A.浓氨水与CaO反应生成氨气,收集氨气利用向下排空气法,图中制取及收集均合理,故A正确;
B.氧化铁与Al反应生成氧化铝和Fe,点燃镁条引发铝热反应,则图中装置可制金属Fe,故B正确;
C.乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,饱和碳酸钠除去乙酸、乙醇、与乙酸乙酯分层,图中装置可制备乙酸乙酯,故C正确;
D.能使高锰酸钾褪色的气体具有还原性,可能为乙烯、二氧化硫等,则不能验证混合气体中一定含有乙烯,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握常见物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
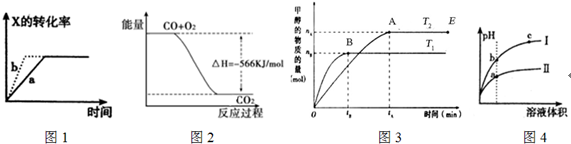
| A. | 图1所示,反应X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2═CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X可以发生加成反应 | |
| B. | 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同 | |
| C. | 步骤②需要在氢氧化钠醇溶液中反应 | |
| D. | 步骤①的反应类型是水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ②③⑥ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
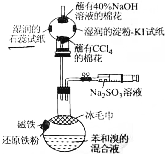 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.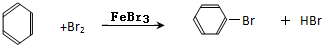 ,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com