
分析 根据1个水分子是由两个氢原子和1个氧原子构成来分析,利用H、O的质量数来计算水的相对分子质量.
解答 解:因1个水分子是由两个氢原子和1个氧原子构成,则16O与2个1H、16O与2个2H、16O与2个3H、相对分子质量分别为:18、20、22;
17O与2个1H、17O与2个2H、17O与2个3H相对分子质量分别为:19、21、23;
18O与2个1H、18O与2个2H、18O与2个3H相对分子质量分别为:20、22、24;
16O与1H和2H、17O与1H和2H、18O与1H和2H相对分子质量分别为:19、20、21;
16O与1H和3H、17O与1H和3H、18O与1H和3H相对分子质量分别为:20、21、22;
16O与2H和3H、17O与2H和3H、18O与2H和3H相对分子质量分别为:21、22、23;
所以相对分子质量不同的水分子种数为18、19、20、21、22、23、24,共7种,
故答案为:18;7.
点评 本题主要考查了同位素的概念以及相对分子质量不同的水分子种数的计算,题目难度中等,注意利用H、O的相对原子质量来计算相对分子质量不同的水分子种数,为该题易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:Ag+Cl--e-═AgCl | |
| B. | AgCl是氧化产物 | |
| C. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
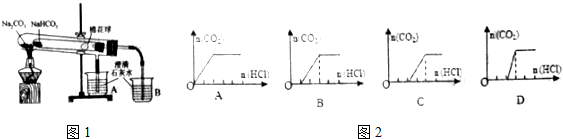
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | NaH中的H为+1价 | |
| C. | 氧化剂是H2O | |
| D. | 每摩尔NaH参加反应时电子转移数为1e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的水溶液能导电,所以CO2是电解质 | |
| B. | 氧化剂在反应中得到的电子越多,氧化能力越强 | |
| C. | 分散质粒子大小为几纳米到几百十纳米的分散系是胶体 | |
| D. | Cl2的氧化性比I2强,而I-的还原性却比Cl-强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
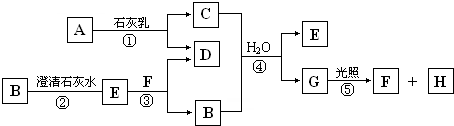
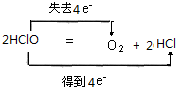 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com