
(共14分)氟是一种氧化性极强的非金属元素,它甚至能与稀有气体氙反应生成XeF2、XeF4、XeF6等固体,这些固体都极易与水反应。其中XeF2与H2O仅发生氧化还原反应,而XeF4与H2O反应时,有一半的XeF4与H2O发生氧化还原反应,另一半则发生歧化反应:3Xe(Ⅳ)→Xe+2Xe(Ⅵ)。XeF6则发生非氧化还原反应完全水解。试回答下列问题:
(1) 写出XeF4与H2O反应的方程式 ;
(2) 14.72gXeF6完全水解后,再加入100mL 0.600mol?L-1 Mn2+的水溶液,反应完全后,放出的气体干燥后再通过红热的金属铜,体积减少20%。
① 通过计算可确定Mn2+的氧化产物为 ,相应的化学方程式为:
;
② 将所得溶液稀释到1000mL后,求溶液pH以及氟离子浓度。(已知弱酸HF在水溶液中存在电离平衡,Ka=![]() =3.5×10-4)溶液的pH为 ,F-浓度为 mol?L-1。
=3.5×10-4)溶液的pH为 ,F-浓度为 mol?L-1。
(3) 合成XeF2、XeF4、XeF6时通常用Ni制反应容器,使用前用F2使之钝化。
① 上述化合物的分子构型分别是 ;
② 使用Ni制反应容器前用F2钝化的两个主要原因是
;
③ 红外光谱和电子衍射表明XeF6的结构绕一个三重轴发生畸变。画出XeF6结构发生畸变的示意图:
(1) 6XeF4+12H2O![]() 4Xe+3O2+2XeO3+24HF (2分)
4Xe+3O2+2XeO3+24HF (2分)
(2)
① MnO4- (2分)
5XeO3+6Mn2++9H2O![]() 5Xe+6MnO4-+18H+ 2XeO3
5Xe+6MnO4-+18H+ 2XeO3![]() 2Xe+3O2
2Xe+3O2
(或:12XeO3+12Mn2++18H2O![]() 12Xe+12MnO4-+3O2+36H+ (2分)
12Xe+12MnO4-+3O2+36H+ (2分)
(提示:XeF6+3H2O![]() XeO3+6HF
XeO3+6HF
XeO3![]() Xe+3/2O2 (a)
Xe+3/2O2 (a)
14.72gXeF6为0.06mol,生成XeO3为0.06mol,共放出Xe气体0.06mol,被铜吸收的O2为0.06/4=0.015mol,由此可知发生反应(a)的XeO3为0.01mol,氧化Mn2+的XeO3为0.05mol,Mn2+为0.06mol,Mn2+的氧化产物应为MnO4-)
② 0.74 7.0×10-4 (2分)
(3)
① 直线形、平面正方形、畸变八面体 (2分)
② Ni器表面生成NiF2保护膜;除去表面氧化物,否则表面氧化物与XeFx反应 (2分)
③ 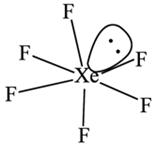 (2分)
(2分)


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com