


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、②④ | B、②③ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲为Fe丙为 Fe2O3 |
| B、甲为F2丙为O2 |
| C、甲为KH丙为 H2 |
| D、甲为CaC2丙为C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
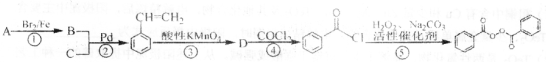
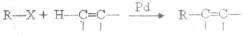
 ),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;
),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |
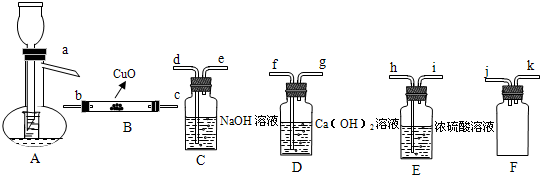
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
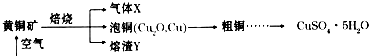
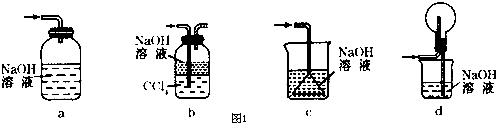
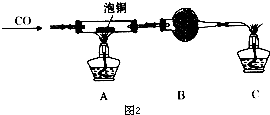
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol |
| B、0.4 mol |
| C、0.6mol |
| D、2.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1 mol/L FeCl3溶液,忘溶液中加入足量铁粉,在加入少量KSCN溶液 | 加入铁粉后,溶液颜色变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com