
分析 (1)氨分解反应的焓变△H>0,熵变△S>0,由反应自发性的综合判据△H-T△S<0来回答;
(2)①2NH3(g)?N2 (g)+3H2(g)△H=92.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
③NH3(l)?NH3 (g)△H=23.4kJ•mol-1
③×4+①×2+②×3得:4NH3(l)+3O2 (g)═2N2(g)+6H2O(g)由盖斯定律计算焓变;
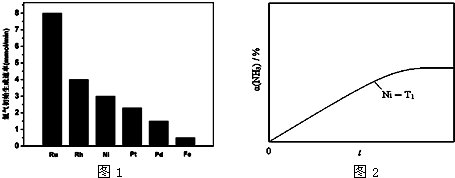
(3)①从图1可看出,Fe作催化剂时,氨分解的活化能最大;
②温度不变,则平衡常数不变,平衡状态也不变;
③温度升高,平衡正向移动,氨气的转化率α(NH3)增大,反应速率大;
④氨气的起始浓度为c0,平衡浓度为0.6c0,氨气的转化浓度为0.4c0,则N2的平衡浓度为0.2c0,H2的平衡浓度为0.6c0,据此计算K;
(4)Pt为惰性电极,对液氨进行电解时,阴极NH2-得电子生成H2,阳极NH4+失电子生成N2.
解答 解:(1)氨分解反应的焓变△H>0,熵变△S>0,由反应自发性的综合判据△H-T△S<0,即T>$\frac{△H}{△S}$可知氨自发分解的条件应该是高温.故答案为:高温;
(2)①2NH3(g)?N2 (g)+3H2(g)△H=92.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
③NH3(l)?NH3 (g)△H=23.4kJ•mol-1
③×4+①×2+②×3得:4NH3(l)+3O2 (g)═2N2(g)+6H2O(g)
由盖斯定律可得:△H=23.4kJ•mol-1×4+92.4kJ•mol-1×2+(-483.6kJ•mol-1)×3=-1172.4kJ•mol-1.故答案为:-1172.4kJ•mol-1;
(3)①从图1可看出,Fe作催化剂时,氢气的初始生成速率最小,根据碰撞理论的解释,催化剂的催化原理实质上是降低反应的活化能,活化能越低,则活化分子百分数越高,反应速率越大,所以上述金属比较,铁作催化剂时,氨分解的活化能最大.故答案为:Fe;
②温度不变,则平衡常数不变,平衡状态也不变,但金属钌(Ru)的催化效果比镍(Ni)显著,所以反应到达平衡所需时间短,答案见图曲线Ru-T1,故答案为: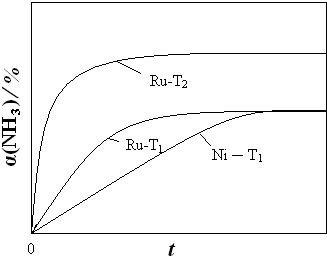 ;
;
③温度升高,平衡正向移动,氨气的转化率α(NH3)增大,反应速率大,反应到达平衡的时间缩短,答案见图曲线 Ru-T2.故答案为: ;
;
④氨气的起始浓度为c0,平衡浓度为0.6c0,氨气的转化浓度为0.4c0,则N2的平衡浓度为0.2c0,H2的平衡浓度为0.6c0,故K=$\frac{0.2{c}_{0}×(0.6{c}_{0})^{3}}{(0.6{c}_{0})^{2}}$=0.12c02,
故答案为:0.12c02;
(4)Pt为惰性电极,对液氨进行电解时,阴极NH2-得电子生成H2,阳极NH4+失电子生成N2,其电极反应分别为:2NH3+2e-═H2+2NH2-;2NH3-6e-═N2+6H+.
故答案为:2NH3+2e-═H2+2NH2-;2NH3-6e-═N2+6H+.
点评 本题考查反应的自发性判断、盖斯定律的应用、化学反应速率和化学平衡的影响因素、化学平衡常数的计算、电极反应式的书写等及图象分析能力与分析解决化学问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$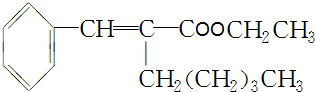 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
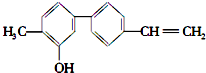
| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | CO2 | C. | HNO3 | D. | 乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com