
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
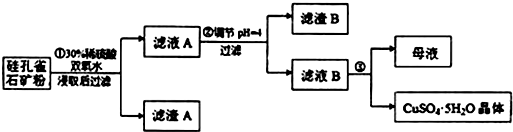
分析 硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣主要为SiO2、H2SiO3,滤液A在含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液pH=4使铁离子全部沉淀,此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体,
(1)硅酸铜和硫酸反应生成硫酸铜、硅酸,双氧水具有强氧化性,可氧化亚铁离子;
(2)调节pH时注意不能引入新杂质;
(3)根据氢氧化物开始沉淀和完全沉淀的pH列表进行分析PH=4完全沉淀、不完全沉淀的离子;
(4)根据氢氧化铝的溶度积以及溶液的pH=4,计算出铝离子的浓度,再进行判断是否有硫酸铝析出.
解答 解:(1)利用质量守恒定律,可以判断未知物是硅酸,利用观察法配平反应方程式为:CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;双氧水将亚铁离子氧化成铁离子的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:H4SiO4;2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)由于滤液A显示酸性,加入的试剂能够中和溶液中的氢离子,还不能引进新的杂质,所以应该选用B氧化铜,故答案为:B;
(3)有表中数据可知,pH=4时,三价铁离子完全生成了氢氧化铁沉淀,而铝离子完全沉淀需要的pH是5.2,所以铝离子没有完全沉淀,
故答案为:Fe3+;Al3+;
(4)pH=4时,溶液中的氢氧根离子的浓度为:1×10-10mol/L,溶液中铝离子浓度为:$\frac{3.2×1{0}^{-34}}{({1×1{0}^{-10})}^{3}}$mol/L=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出,
故答案为:该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的熬成,题目侧重考查了化学方程式书写、误差分析、化学计算等知识,难度中等.


科目:高中化学 来源: 题型:解答题
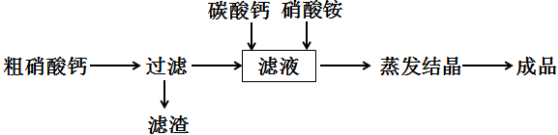

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)
200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)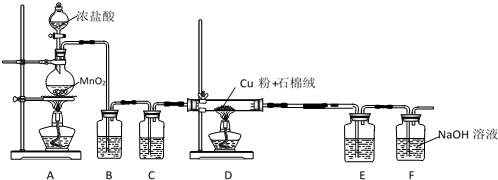
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
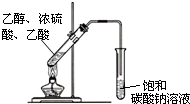 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+534 kJ•L-1 | |
| B. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-53.4 kJ•L-1 | |
| C. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+53.4 kJ•L-1 | |
| D. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-534 kJ•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
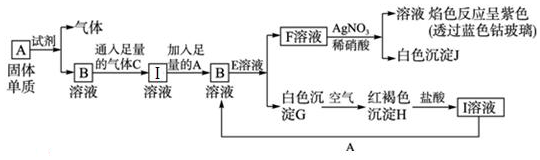
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com