
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
A.KClO3是氧化剂 B.被氧化与被还原的氯元素的质量比为5:1
C.H2SO4既不是氧化剂又不是还原剂 D.1mol KClO3参加反应时有10mol电子转移
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
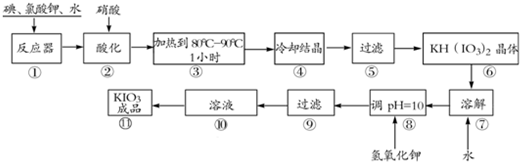
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第一次联考理综化学试卷(解析版) 题型:填空题
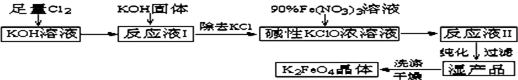
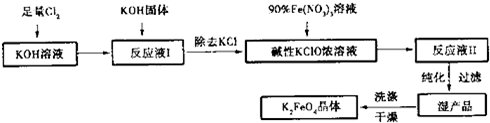
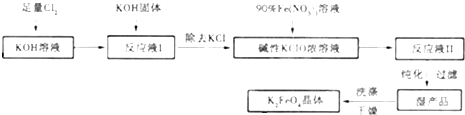
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
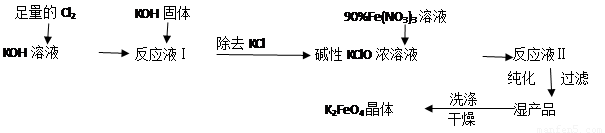
已知:①2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
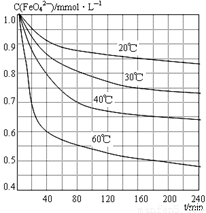
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com