
| A.两溶液的导电能力相同 |
| B.分别稀释100倍后,溶液pH相同 |
| C.盐酸中水的电离程度比醋酸中的小 |
| D.分别与足量Zn反应时,醋酸中生成的n(H2)较多 |
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| B.等物质的量的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.pH=2的HA溶液与pH=12的MOH溶液等体积混合: c(M+)=c(A-)>c(OH-)=c(H+) |
| D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
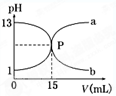
| A.盐酸的物质的量浓度为1 mol/L |
| B.P点时反应恰好完全,溶液呈中性 |
| C.曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D.酚酞不能用作本实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH(l) + 3/2O2(g) ="=" CO2(g) + 2H2O(l); △H =" +726.5KJ/mol" |
| B.CH3OH(l) + 3/2O2(g) ="=" CO2(g) + 2H2O(l); △H =" -726.5KJ/mol" |
| C.CH3OH(l) + 3/2O2(g) ="=" CO2(g) + 2H2O(g); △H =" -675.3KJ/mol" |
| D.2CH3OH(l) + 3O2(g) ="=" 2CO2(g) + 4H2O(l); △H = -1453KJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a=b |
| B.混合溶液的PH=7 |
| C.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-) |
D.混合溶液中,c(H+)= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10a+b-12 % | B.10a+b-14 % | C.1012-a-b % | D.1014-a-b % |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此时水的离子积Kw=1×10-12 |
| B.水电离出的c(H+)=1×10-10 mol/L |
| C.水的电离度随温度升高而增大 |
| D.若加入等体积pH=12的NaOH溶液,溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com