
【题目】在Na2O2与水反应中,叙述正确的是 ( )
A. O2是还原产物 B. NaOH是氧化产物
C. Na2O2是氧化剂,水是还原剂 D. Na2O2既是氧化剂,又是还原剂
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线_____。
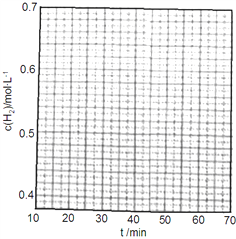
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是_____(填增大、减少或不变)。
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式______________________。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于__________(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(I) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。
![]()
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是( )
A.能与溴水发生加成反应
B.能使酸性高锰酸钾溶液褪色
C.与氯化氢反应可以生成氯代苯乙烯
D.在催化剂存在下可以制得聚苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是
A. 硝酸、生石灰、石灰石 B. 醋酸、纯碱、食盐
C. 盐酸、乙醇、硝酸钾 D. 硫酸、烧碱、碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为
A. 56m/V mol·L-1 B. 3m/56V mol·L-1
C. m/56V mol·L-1 D. 3m/112V mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.HF溶于少量水中:HF+H2OF﹣+H3O+
B.H2S溶于水:H2S2H++S2﹣
C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣
D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造的115号元素被我国命名为“镆”,取自我国古代宝剑之名“镆铘”。下列相关叙述正确的是
A.镆元素的质量数为115B.镆铘剑中可能含有镆
C.镆原子的中子数为115D.镆铘剑中一定不含镆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答: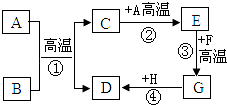
(1)物质B、E和F的化学式为B、E、F;
(2)反应①的化学方程式为: , 其反应类型为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com