


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 常温下将铝片放入浓硫酸中 | 无明显现象 | 铝与浓硫酸不反应 |
| B | 某溶液中先加入氯化钡溶液后加入稀盐酸 | 加氯化钡溶液有白色沉淀生成,后加稀盐酸沉淀不溶解 | 原溶液中,一定存在SO42- |
| C | 将浓硫酸滴到蔗糖表面 | 蔗糖固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| D | 将Cl2通入紫色石蕊试液中 | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
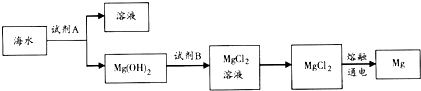
 利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等.
利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等.查看答案和解析>>
科目:高中化学 来源: 题型:
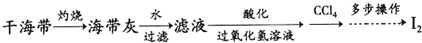
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠溶液pH>7 |
| B、醋酸溶液能溶解碳酸钙 |
| C、0.1mol?L-1醋酸溶液pH=2.9 |
| D、pH=1的醋酸溶液稀释100倍后pH<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2与过量的镁铁反应,转移2NA个电子 |
| B、常温下,16g CH4含有8NA个电子 |
| C、1L 0.5mol?L-1 Na2SO4溶液中含有NA个SO42- |
| D、常温常压下,22.4L CO2含有NA个CO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com