
分析 由草酸二乙酯结构可知需要得到HOOC-COOH、CH3CH2OH,乙烯与水发生加成反应得到乙醇,乙二酸可以由OHC-CHO氧化得到,而OHC-CHO可以由HOCH2CH2OH氧化得到,HOCH2CH2OH由BrCH2CH2Br在氢氧化钠 水溶液、加热条件下水解生成,乙烯与溴发生加成反应得到BrCH2CH2Br.
解答 解:乙烯与水发生加成反应得到乙醇,乙二酸可以由乙烯与溴水加成生成BrCH2CH2Br,HOCH2CH2OH由BrCH2CH2Br在氢氧化钠水溶液、加热条件下水解生成,而OHC-CHO可以由HOCH2CH2OH氧化得到OHC-CHO,HOOC-COOH,OHC-CHO与HOOC-COOH酯化得到草酸二乙酯,
故答案为:①CH2=CH2+H2O$→_{△}^{催化剂}$ CH3CH2OH;
②CH2=CH2+Br2$\stackrel{一定条件}{→}$ CH2BrCH2Br;
③CH2ClCH2Br+2NaOH$→_{△}^{水}$ CH2OHCH2OH+2NaBr;
④OHCH2CH2OH+O2 $\stackrel{催化剂}{→}$OHCCHO+2H2O;
⑤CHOCHO$→_{O}^{催化剂}$HOOCCOOH;
⑥HOOCCOOH+2CH3CH2OH $→_{△}^{催化剂}$CH3CH2OOCCOOCH2CH3+2H2O.
点评 本题考查有机物合成,逆合成分析法是合成中常用方法,注意熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
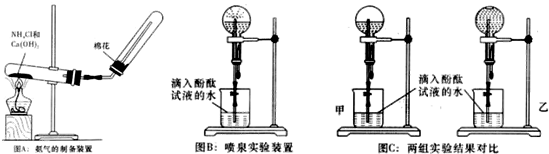
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
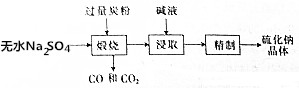 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合的离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的结构示意图: | |
| B. | 氢氧根离子的电子式: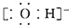 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com