
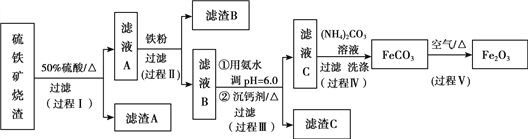
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
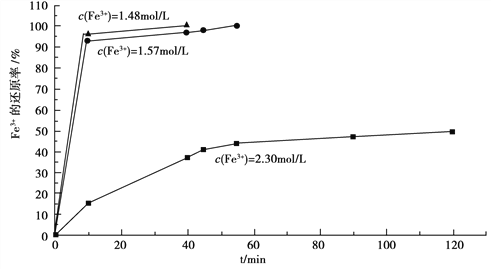
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
【答案】 SiO2 Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ KSCN c(Fe3+)在1.60mol/L左右时,反应速率更快,Fe3+的还原率更高 CaF2、Al(OH)3 温度过高,(NH4)2CO3易分解(其他合理答案) 4FeCO3+O2![]() 2Fe2O3+4CO2↑
2Fe2O3+4CO2↑
【解析】硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)用50%的硫酸溶解后,只有SiO2不溶,滤渣A为SiO2,滤液A中含有硫酸铁、硫酸亚铁、硫酸铝和硫酸钙,滤液A中加入铁粉将铁离子还原生成亚铁离子,过滤后,滤渣B主要含有过量的铁,滤液B中加入氨水,调节pH=6和沉钙剂,除去铝离子和钙离子,滤液C中加入(NH4)2CO3得到碳酸亚铁,在空气中灼烧得到氧化铁。
(1)根据上述分析,滤渣A的主要成分为SiO2,故答案为:SiO2;
(2)过程Ⅱ中加入铁粉,铁与过量的硫酸反应生成氢气,铁将铁离子还原,溶液颜色慢慢变浅,涉及的离子方程式有Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+,反应后,可以用KSCN溶液检验说明Fe3+是否已经完全反应,故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;KSCN;
(3)根据图像,c(Fe3+)在1.60mol/L左右时,反应速率更快,Fe3+的还原率更高,因此选择稀释后c(Fe3+)为1.60mol/L左右,故答案为:c(Fe3+)在1.60mol/L左右时,反应速率更快,Fe3+的还原率更高;
(4)根据表格数据可知,选择NH4F作沉钙剂,滤液B中钙的含量最低,因此滤渣C的主要成分有氢氧化铝和CaF2,故答案为:CaF2、Al(OH)3;
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,因为温度过高,(NH4)2CO3易分解,故答案为:温度过高,(NH4)2CO3易分解;
(6)在过程Ⅴ中,碳酸亚铁被空气中的氧气氧化,反应的化学方程式为4FeCO3+O2![]() 2Fe2O3+4CO2↑,故答案为:4FeCO3+O2
2Fe2O3+4CO2↑,故答案为:4FeCO3+O2![]() 2Fe2O3+4CO2↑。
2Fe2O3+4CO2↑。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
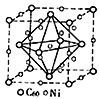
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要反应原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。下列说法正确的是
2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。下列说法正确的是
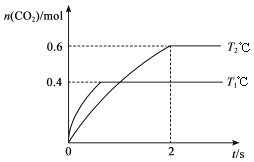
A. 该反应是吸热反应
B. T1℃时,K=0.9
C. T2℃时,0~2s内的平均反应速率v(N2)=0.075 mol/(L·s)
D. T1℃时,向平衡体系中加入1 mol NO,再次平衡时NO转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | BaCO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g)△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lw mol·L-lCH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述正确的是
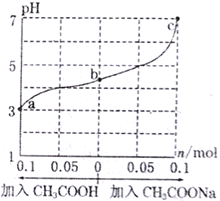
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
B. b点混合液中c(Na+)>c(CH3COO-)
C. 加入CH3COOH过程中,![]() 增大
增大
D. 25℃时,CH3COOH的电离平衡常数Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池,其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+ . 下列说法正确的是( )
VO2++2H++V2+ . 下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e﹣=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极
D.放电过程中,H+由正极移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com