
 草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 | |
| ①组 | 40℃ | 10ml | 10ml | 40s |
| ②组 | 40℃ | 20ml | 20ml |
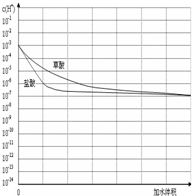 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、高纯度的二氧化硅晶体广泛用作制造光导纤维和太阳能电池板材料 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水中含有钾、钠元素,只需经过物理变化就可以得到钾和钠单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
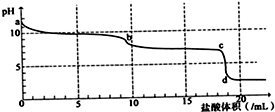 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )| A、a点时溶液pH=11.5,原因是:CO32-+H2O→HCO3-+OH- |
| B、a-b段发生反应为:CO32-+2H+→CO2↑+H2O |
| C、b-c段发生反应为:HCO3-+H+→CO2↑+H2O |
| D、c-d段发生反应为:H++OH-→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
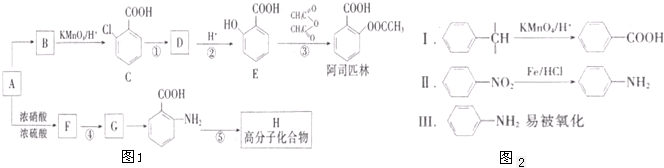
 ,生产过程如图:
,生产过程如图:
 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,R、R′均为烃基
,R、R′均为烃基查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com