
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |
| △c(H2) |
| △t |
| △c(H2) |
| △t |
| 0.06mol?L -1 |
| 4min |


科目:高中化学 来源: 题型:
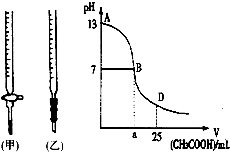 图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:
图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 甲基橙 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
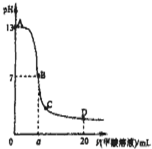 向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )
向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )| A、在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+) |
| D、在D点:c(HCOO-)+c(HCOOH)>2c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、HCO3-的电离程度大于HCO3-水解程度 |
| D、存在的电离有NaHCO3=Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:2 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和C2H4 |
| B、C2H2和C2H4 |
| C、C2H4和C2H6 |
| D、C3H4和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com