
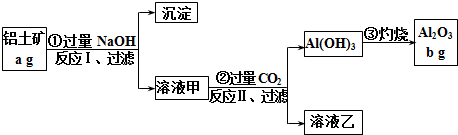
分析 铝土矿(主要成分是Al2O3、含杂质Fe2O3)中加入氢氧化钠溶液,氧化铝与氢氧化钠反应生成偏铝酸钠,则溶液甲为NaAlO2溶液,沉淀为Fe2O3,滤液中通入过量的二氧化碳,生成Al(OH)3沉淀,过滤,滤液乙为碳酸氢钠溶液,氢氧化铝灼烧得氧化铝,根据氧化铝的质量可计算得铝元素的质量,据此可确定铝土矿的铝元素的含量,据此答题.
解答 解:铝土矿(主要成分是Al2O3、含杂质Fe2O3)中加入氢氧化钠溶液,氧化铝与氢氧化钠反应生成偏铝酸钠,则溶液甲为NaAlO2溶液,沉淀为Fe2O3,滤液中通入过量的二氧化碳,生成Al(OH)3沉淀,过滤,滤液乙为碳酸氢钠溶液,氢氧化铝灼烧得氧化铝,根据氧化铝的质量可计算得铝元素的质量,据此可确定铝土矿的铝元素的含量,
(1)步骤③为灼烧固体,用到的仪器有三脚架、酒精灯以及坩埚、泥三角、(坩埚钳),
故答案为:坩埚、泥三角、(坩埚钳);
(2)溶液乙为碳酸氢钠溶液,碳酸氢钠可用作发酵、治疗胃酸过多、泡沫灭火器等等,
故答案为:发酵、治疗胃酸过多、泡沫灭火器等等;
(3)反应Ⅰ的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)反应II的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(5)根据流程可知,氧化铝的质量为bg,则铝元素的质量为$\frac{54}{102}$×bg=$\frac{27}{51}$×bg,所以样品中铝的质量分数是:$\frac{\frac{27}{51}b}{a}$=$\frac{9b}{17a}$×100%,
故答案为:$\frac{9b}{17a}$×100%;
(6)A.第①步中加入溶液不足,氧化铝未能全溶解,则测得的氧化铝的质量偏小,所以会使测定结果偏小;
B.第②步中通入CO2不足,则铝未完全沉淀,会使氧化铝的质量偏小,所以会使测定结果偏小;
C.第②步中的沉淀未用蒸馏水洗涤,表面会有碳酸氢钠杂质,会使氧化铝的质量偏大,所以会使测定结果偏大;
D.第③步对沉淀灼烧不充分,则测得的氧化铝的质量偏大,会使测定结果偏大,
故选CD.
点评 本题考查混合物的分离和提纯,侧重考查实验基本操作、元素化合物性质,明确流程图中各个步骤发生的反应及物质分离方法是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、HCO3- | |
| B. | 使pH试纸显蓝色的溶液:K+、Cu2+、Cl-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液:Na+、NH4+、ClO4-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol/L的溶液:K+、NH4+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫比正交硫稳定 | |
| B. | 单斜硫转化为正交硫需要放出热量 | |
| C. | 单斜硫升华为气态时要吸收热量 | |
| D. | 将同态的硫单质气化或液化能提高它们的燃烧效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 物质A和B混合时会发生放热反应.将等物质的量的浓度的A和B溶液,以不同的体积比混合,但总体积始终保持100mL.混合后体系的最高温度如图所示,则A、B两种物质反应时其物质的量的之比是( )
物质A和B混合时会发生放热反应.将等物质的量的浓度的A和B溶液,以不同的体积比混合,但总体积始终保持100mL.混合后体系的最高温度如图所示,则A、B两种物质反应时其物质的量的之比是( )| A. | 1:3 | B. | 3:2 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 、
、 ,属于两性化合物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.
,属于两性化合物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的硫酸 | B. | 0.01mol/L的硝酸 | C. | 0.01mol/L的甲酸 | D. | pH=2的醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | |
| B. | W的最高价氧化物对应的水化物酸性比R的强 | |
| C. | W与X形成的是离子化合物 | |
| D. | W的气态氢化物的热稳定性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸 | B. | 氢硫酸 | C. | 硝酸 | D. | 碘化钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com