
【题目】高纯度单晶硅是典型的无机非金属材料,又称半导体材料,它的发现和使用曾引起计算机的一场革命,这种材料可以按下列方法制备,下列说法正确的是
![]()
A.二氧化硅的分子式是SiO2
B.步骤①的化学方程式是SiO2 + C ![]() Si + CO2↑
Si + CO2↑
C.步骤③中,每生成1mol Si,转移4mol电子
D.二氧化硅能与氢氟酸发生反应,而硅单质不能与氢氟酸发生反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
B.氯气与水反应:Cl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2加氢合成低碳烯烃技术能有效利用CO2,以合成C2H4为例。该转化分为两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.3kJ/mol
CO(g)+H2O(g) ΔH1=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为__。
(2)利用CO2和H2合成甲醇又是一个有效利用CO2的途径,反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①在容积为2L的恒容密闭容器中,通入2molCO2和3molH2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__(填字母)
a.消耗1.5molH2时,有0.5molCH3OH生成
b.转移3mol电子时,消耗11.2L(标准状况下)CO2
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2与生成H2O的物质的量之比为3:1
②研究温度对该反应甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速发生上述反应。得到甲醇平衡产率与温度的关系如图所示,ΔH3__0(填“>”、“=”或“<”)。判断依据是__。
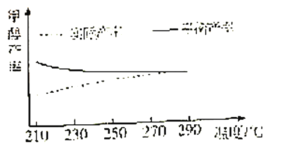
③在一固定容积的密闭容器中发生上述反应。若要提高平衡时CH3OH产率,则可以采取的措施是__(填字母)。
a.升温 b.加入催化剂 c.增加CO2的浓度 d.加入H2加压 e.加入惰性气体 f.分离出甲醇
(3)在一定温度和催化剂作用下,也可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0. | a | 1.6 |
则a=__,该反应平衡常数K=__。
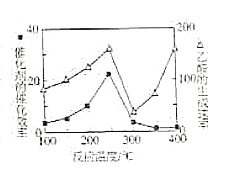
(4)以TiO2/Cu2Al2O4为催化剂,利用CH4可以将CO2直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示,乙酸的生成速率主要取决于温度影响的范围是__。250~300℃时,温度升高而乙酸的生成速率降低的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中常见的有机物,两者均可通过粮食酿造获得。
(1)乙醇和乙酸所含官能团的名称分别为______、______。
(2)可用于鉴别乙醇和乙酸的化学试剂是:______。(回答一种即可)
(3)写出乙醇与乙酸反应制取乙酸乙酯的化学方程式。______。
(4)工业上可用乙烯与水反应制取乙醇,该反应类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯,乙酸正丁酯是中学化学实验中的两个重要有机实验
①乙酸乙酯的制备
②乙酸丁酯![]() 的制备
的制备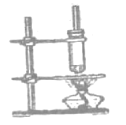
完成下列填空:
(1)制乙酸乙酯的化学方程式___________。
(2)制乙酸乙酯时,通常加入过量的乙醇,原因是________,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;浓硫酸用量又不能过多,原因是_______________。
(3)试管②中的溶液是________,其作用是________________。
(4)制备乙酸丁酯的过程中,直玻璃管的作用是________,试管不与石棉网直接接触的原因是_____。
(5)在乙酸丁酯制备中,下列方法可提高1-丁醇的利用率的是________(填序号)。
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
(6)两种酯的提纯过程中都需用到的关键仪器是________,在操作时要充分振荡、静置,待液体分层后先将水溶液放出,最后将所制得的酯从该仪器的________(填序号)
A.上口倒出 B.下部流出 C.都可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是
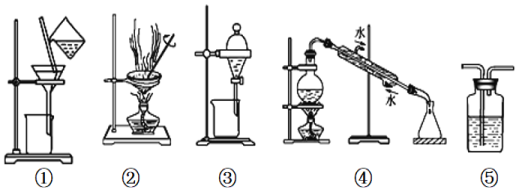
A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同容积的4个密闭器中进行同一种可逆反应,2A(g)+B(g)![]() 3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
容器 | 甲 | 乙 | 丙 | 丁 |
A | 2mol | 1mol | 2mol | 1mol |
B | 1mol | 1mol | 2mol | 2mol |
在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是
A.A的转化率为:甲<丙<乙<丁B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>丙>乙>丁D.B的转化率为:丁>乙>丙>甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com