
����Ŀ����.����4FeS2+11O2�T2Fe2O3+8SO2���Իش��йص����⣺
��1����ѡ����Щ����Ũ�ȵı仯����ʾ�÷�Ӧ������____________��
��2��Ϊ���������SO2�����ʣ����Բ�ȡ�Ĵ�ʩ��______________��
A������FeS2���� B������O2��Ũ�� C�������¶� D����Сѹǿ
����ij���淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0��3���Ӹ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩
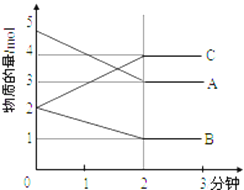
��3���÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
��4����һ���¶��£����������ܱ������У�������Ӧ�ﵽƽ��ı�־��_______________
A���������������ֲ���
B��A��B��C��Ũ�ȶ����
C��A��B��C��Ũ�Ȳ��ٷ����仯
D��A��B��C�ķ�����֮��Ϊ2��1��2
E������Ӧ���淴Ӧ����ֹͣ
F�������������ܶȲ��ٷ����仯��
���𰸡� O2��SO2 B C 2A+B2C C
�����������������������1��FeS2��Fe2O3Ϊ���壬����������ʾ��Ӧ���ʣ�O2 ��SO2Ϊ���壬����O2 ��SO2Ũ�ȵı仯����ʾ�÷�Ӧ�����ʡ�
��2��A��FeS2Ϊ���壬����FeS2��������Ӱ�컯ѧ��Ӧ���ʣ�����B������O2��Ũ�ȣ���Ӧ��Ũ�ȱ��Ӧ���ʼӿ죬��ȷ��C�������¶ȣ���ѧ��Ӧ���ʼӿ죬��ȷ��D����Сѹǿ����Ӧ���ʼ�С������
������3������ͼ���֪A��B���ʵ������٣�Ϊ��Ӧ�C���ʵ�������Ϊ�����2����ʱ�ﵽƽ�⣬�÷�ӦΪ���淴Ӧ��0��2����A��B��C���ʵ����ñ����ֱ�Ϊ2mol��1mol��2mol�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ��2A(g) + B(g)![]() 2C(g)��
2C(g)��
��4��A�����������غ㣬���۷�Ӧ�Ƿ�ƽ�⣬�������������ֲ��䣬�����������������ֲ��䲻���жϷ�Ӧ�ﵽƽ�⣬����B��A��B��C��Ũ���Ƿ�����뷴Ӧ�Ƿ�ƽ���أ�����C��A��B��C��Ũ�Ȳ��ٷ����仯��˵������Ӧ���ʵ����淴Ӧ���ʣ�˵����Ӧ�ﵽƽ�⣬��ȷ��D��A��B��C�ķ�����֮���뷴Ӧ�Ƿ�ƽ���أ�����E����Ӧƽ��ʱ����Ӧ���ʵ����淴Ӧ���ʣ�����0������F�����������غ㶨�ɣ������������䣬����������̶��������Ƿ�ƽ�⣬�ܶȱ��ֲ��䣬���������������ܶȲ��ٷ����仯�������жϷ�Ӧ�ﵽƽ�⣬����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡��ݻ�Ϊ2L���ܱ�������ͨ��1molN2��xmolH2�������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)������5min�ﵽƽ��ʱ�������������ʵ���Ϊ3.6mol�������ڵ�ѹǿ��Ϊԭ����90%���Իش�(����д��Ҫ�ļ��㲽��)��
2NH3(g)������5min�ﵽƽ��ʱ�������������ʵ���Ϊ3.6mol�������ڵ�ѹǿ��Ϊԭ����90%���Իش�(����д��Ҫ�ļ��㲽��)��
��1����ʼʱ����H2�����ʵ���_________��
��2��ƽ��ʱN2��Ũ��_______��
��3��5min����NH3��ʾ�Ļ�ѧ��Ӧ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������´��ڷ�Ӧ��CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H����Q kJ/mol(Q>0)������������ͬ��2 L���ݾ���(�����û����������)�ܱ����������������������г���1 mol CO��1 mol H2O�������г���1 mol CO2��1 mol H2�������г���2 mol CO��2 mol H2O��700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ�������������̶�Ӧ�������仯ֵ�ֱ�ΪQ1��Q2��Q3������˵����ȷ����
CO2(g)��H2(g)����H����Q kJ/mol(Q>0)������������ͬ��2 L���ݾ���(�����û����������)�ܱ����������������������г���1 mol CO��1 mol H2O�������г���1 mol CO2��1 mol H2�������г���2 mol CO��2 mol H2O��700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ�������������̶�Ӧ�������仯ֵ�ֱ�ΪQ1��Q2��Q3������˵����ȷ����
A. 2Q1��2Q2��Q3
B. ��������CO�İٷֺ�������������CO�İٷֺ�����
C. �������з�Ӧ��ƽ�ⳣ�����������з�Ӧ��ƽ�ⳣ��С
D. ��������CO��ת��������������CO2��ת����֮�͵���1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪: 25�桢101 kPa�£��� 2 Na(s) + 1/2 O2(g) = Na2O(s) ��H1 = - 414 kJ / mol
�� 2 Na(s) + O2(g) = Na2O2(s) ��H2 = - 511 kJ / mol
����˵����ȷ����
A. ������������������Ӹ����Ȳ����
B. ���������ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C. ������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D. 25�桢101 kPa�£�Na2O2(s) + 2 Na(s) = 2 Na2O(s) ��H = -317 kJ / mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ͻ�������������й㷺Ӧ�á�
��1�������о�����������������������������Һ������Na[Al(OH)4]��������������ˮ�з�����ʽ����ĵ��뷽��ʽΪ________________________________��
��2��Ŀǰ�����ڶ����̼�Ȼ�ԭ-�Ȼ���ұ�������о��϶࣬���ø÷���ұ�����������Ƚ����ֻ�����
��֪����Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) ��H1
��3AlCl(g)====2Al(l)+AlCl3(g) ��H2
��Al(l)====Al(s) ��H3
��Al2O3(s)+3C(s)====2Al(s)+3CO(g) ��H4=___________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
��3����֪��Al4C3�����̼�Ȼ�ԭ-�Ȼ���ұ�������м�������ˮ��Ӧ��������Y��Y�Ǻ���������������2L�����ܱ������г���2mol Y��2molˮ������һ�������·�����Ӧa Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) ��H�����Y��ƽ��ת���ʦ�(Y)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
c CO(g)+dH2(g) ��H�����Y��ƽ��ת���ʦ�(Y)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
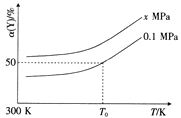
��������Ӧ�ġ�H_______0(�>����<����=��)��
��ͼ���У�x_________0.1(�>����<����=��)��
����T0K��0.1MPaʱ��������Ӧ��ƽ�ⳣ��K=____________��
�����������Ӧ�ķ�Ӧ���ʵĴ�ʩ��_______________________________ (�������)��
�ݴ�������Ӧ��ϵ�з����H2(����������CO)��Ϊ�ϳɰ���ԭ������Ϊ����COʹ�����ж���ԭ������ͨ��ϳ���֮ǰ��������NH3��ϣ�����[Cu(NH3)2]Ac��Һ����CO����Ӧԭ��Ϊ[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac��CO(aq) ��H<0�������¶ȡ�ѹǿ�����濼�ǣ���[Cu(NH3)2]Ac��Һ����CO������������________________________��
[Cu(NH3)3]Ac��CO(aq) ��H<0�������¶ȡ�ѹǿ�����濼�ǣ���[Cu(NH3)2]Ac��Һ����CO������������________________________��
��4���ҹ��״��ĺ�ˮ���������Ϊ�������ԽӴ������������Ͻ���Ϊ�������������Եĺ�ˮΪ�������Һ������ܷ�ӦΪ4Al+3O2+6H2O===4Al(OH)3����д����ˮ��ص�������Ӧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶�����������淢չ������Ҫ��������ѧ��һֱ�����ڡ��˹��̵������·����о���
��1������ֲ��ĸ���������һ�̵ֹ�ø�����ڳ����½������еĵ���ת��Ϊ������������ĺ���������������˵���������____(����)��
a���̵�ø��һ�ֵ�����
b���̵�ø�ܽ��̵���Ӧ�������������
c���̵�ø��ʹ�̵���Ӧ��ƽ�������ƶ�
d���̵�ø�ܼӿ�̵���Ӧ������
��2���ϳɰ���Ŀǰ����Ҫ�Ĺ̵���������ͼΪ�ϳɰ���ӦN2(g)��3H2(g) ![]() 2NH3(g)�ڲ�ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£���ʼʱ���������������֮��Ϊ1��3ʱ��ƽ�������а�����������ı仯���ߡ�
2NH3(g)�ڲ�ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£���ʼʱ���������������֮��Ϊ1��3ʱ��ƽ�������а�����������ı仯���ߡ�
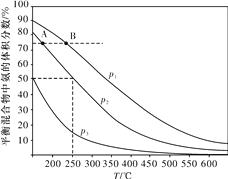
��A��B��ƽ��״̬��Ƚ���ǰ�߽ϴ����____(����)��
a��ƽ�ⳣ��
b��ƽ�������ƽ��Ħ������
c��������ת����
d���ӷ�Ӧ��ʼ���ﵽƽ��״̬����Ҫ��ʱ��
��ͼ��p1��p2��p3�ɴ�С��˳��Ϊ____��
����250 ����p2����H2��ת����Ϊ____%(�������С�����һλ)��
��3���ݱ������ڳ��¡���ѹ��������������N2�ڴ���(��������Fe2O3��TiO2)������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3��һ�ֵ��ʡ���֪��
��H2(g)��![]() O2(g)===H2O(l)����H1����285.6 kJ/mol
O2(g)===H2O(l)����H1����285.6 kJ/mol
��N2(g)��3H2(g) ![]() 2NH3(g)����H2����92.2 kJ/mol
2NH3(g)����H2����92.2 kJ/mol
д���������µ�����ˮ��Ӧ���Ȼ�ѧ����ʽ��___��
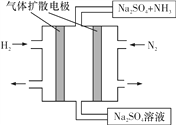
��4����ͼΪһ�ֳ��³�ѹ��ˮ��Һ�е绯ѧ�ϳɰ���ʵ��װ��ʾ��ͼ����ݴ�д����������Ӧ�ĵ缫��Ӧʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������刺���������ƽ�����ʵ���ҿ���NaClO3��ԭ����ȡ(���������ܽ�ȼ���ͼ)����ʵ���������£�
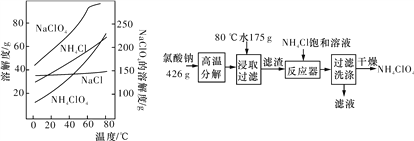
��1�������Ƹ��·ֽ����ɸ������ƺ��Ȼ��ƵĻ�ѧ����ʽΪ____��
��2��80 ��ʱ��ȡҺ��ȴ��0 ����������������Ҫ�ɷ�Ϊ___(д��ѧʽ)��
��3����Ӧ���м����Ȼ�隣�����Һ������Ӧ�����ӷ���ʽΪ___��
��4����֪��2NH4ClO4![]() N2����2O2����Cl2����4H2O���ֿ��ṩ�����Լ���
N2����2O2����Cl2����4H2O���ֿ��ṩ�����Լ���
a������ʳ��ˮ����b��ŨH2SO4����c��NaOH��Һ d��Mg e��Cu f��Fe
������ͼװ�öԸ���������ȷֽ��������������ֱ�������ջ��ռ���
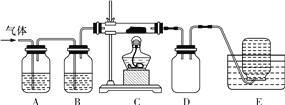
��E���ռ��������������____(�ѧʽ)��
��A��B��C��ʢ�ŵ�ҩƷ���ο�����___(��������������)��
��.a��b��c������.c��b��e������.b��c��f
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������Ǵ�������(��Cr2O72����CrO42��)��ҵ��ˮ�ij��÷������������£�
![]()
��֪ת�������з�ӦΪ��2CrO42��(aq)+2H+(aq)![]() Cr2O72��(aq)+H2O��1����ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
Cr2O72��(aq)+H2O��1����ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
A. ��Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽ��ƽ��״̬
B. �����̷�(FeSO4��7H2O)(M=278)����ԭ��������1L��ˮ��������Ҫ917.4g
C. ������ת����Ӧ��ƽ�ⳣ��K=1��1014����ת����������Һ��pH=6
D. ������Ksp[Cr(OH)3]=1��10��32��Ҫʹ�������ˮ��c(Cr3+)����1��10��5mol/L��Ӧ����Һ��pH=5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ơ�þ������0.3 mol�ֱ����100 mL 1 mol��L��1�������У�ͬ��ͬѹ�²����������������(����)
A. 1��2��3 B. 3��1��1 C. 6��3��2 D. 1��1��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com