
| A. | 用饱和碳酸钠溶液除去乙酸乙醋中的乙酸和乙醇 | |
| B. | 用加人NaOH 溶液、分液的方法来分离甲苯和苯酚的混合液 | |
| C. | 用渗析的方法对蛋白质胶体进行提纯,以净化蛋白质胶体 | |
| D. | 用酸性高锰酸钾溶液除去乙烷中的乙烯 |
分析 A.乙酸乙酯不溶于饱和碳酸钠溶液,但饱和碳酸钠溶液可吸收乙醇和乙酸;
B.苯酚与氢氧化钠反应生成溶于水的苯酚钠;
C.蛋白质不能透过半透膜;
D.乙烯被酸性高锰酸钾氧化生成二氧化碳气体.
解答 解:A.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠反应,乙醇溶于水,可起到分离物质的作用,故A正确;
B.苯酚与氢氧化钠反应生成溶于水的苯酚钠,甲苯不溶于水,可分离,故B正确;
C.蛋白质不能透过半透膜,可用渗析的方法分离,故B正确;
D.乙烯被酸性高锰酸钾氧化生成二氧化碳气体,引入新杂质,应用溴水除杂,故D错误.
故选D.
点评 本题综合考查除杂问题,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质的异同,把握实验方法和注意事项,难度不大.


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | D>B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
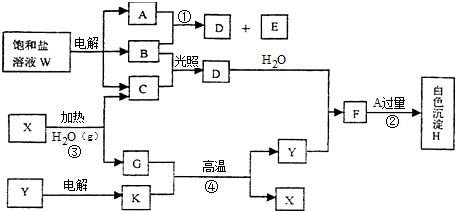
 ,B的晶体类型是分子晶体.
,B的晶体类型是分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
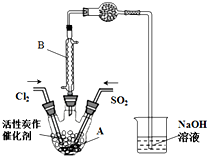 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | T℃时,pH=6的纯水中,含有的OH-数目为1×10-6NA | |
| B. | 标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA | |
| C. | 50g98%的浓硫酸中,所含的氧原子数目为2NA | |
| D. | 1molNa2O2与足量CO2充分反应转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com