
【题目】下列各组离子中,可以大量共存的是 ( )
A. Ag+、NO3-、Cl-、Mg2+ B. OH- 、 Cl- 、 NH4+ 、Na+
C. Ba2+、Cl-、SO42-、Ca2+ D. Mg2+ 、 Cl- 、NO3-、H+
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰固体加热反应来制备氯气(MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题:
MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题: 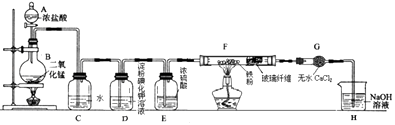
(1)仪器A的名称是 .
(2)C中反应的化学方程式为 , 所得溶液除水分子外,还含有的分子和离子中正确的是 .
A.Cl2、HCl、HClO,H+、Cl﹣ B.Cl2、Mn2+、HClO,H+、Cl﹣
C.Cl2、HClO,H+、Cl﹣、ClO﹣ D.Cl2、HCl、HClO,H+、Mn2+
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,碘单质(I2)遇淀粉显蓝色,且氯气可以从KI中置换出碘单质,写出该反应的化学方程式为 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.E中浓硫酸的作用是 , 双通管F中玻璃纤维(不参与反应)的作用是 .
(5)H中盛有NaOH溶液,其作用是 , 发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与盐类水解无关的是
A.金属焊接时可用NH4Cl溶液作除锈剂 B.配制FeSO4溶液时,加入一定量Fe粉
C.长期施用铵态氮肥会使土壤酸化D.使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________(填字母)。
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH > 0
B.2H2(g)+O2(g)===2H2O(l) ΔH < 0
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH < 0
(2)固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动。
①正极:________ (填“电极a”或“电极b”)。 O2-移向________极(填“正”或“负”)。

②当燃料气为C2H4时,其正极、负极反应式分别为
正极:______________________;负极:____________________。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,则除去甲醇的离子方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含有微量金、银等。下图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图:

(1)CuCl难溶于水,但可与过量Cl-反应生成可溶于水的[CuCl2]-,该反应的离子方程式为________________________________。
(2)有大量Cl-存在时,Na2SO3可将CuCl2还原成[CuCl2]-,因此Na2SO3要缓慢滴入到溶液中的原因是_______________________________。
(3)反应IV中,属于非氧化还原反应的是反应_______________________。
(4)已知反应V中Cu+发生自身氧化还原反应,歧化为Cu2+和Cu,由此可推知溶液A中的溶质为________________(填化学式)。
(5)在酸性、有氧条件下,一种叫做Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程中发生反应的离子方程式为_____________________________。
(6)将一定量铁红溶于160 mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束后共收集气体2.24L(标准状况下),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. Mg、Al与同浓度盐酸反应,Mg更剧烈 B. 向Na2SO3溶液中加盐酸,有气泡产生
C. 0.1 mol·L-1 溶液的碱性:MaOH>LiOH D. 气态氢化物的稳定性:HBr>HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,①pH=1的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸;下列有关说法不正确的是
A. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B. 分别加水稀释10倍,四种溶液的pH ①>②>③>④
C. ①、④两溶液混合后,若溶液呈中性,则所得溶液中c(NH4+)=2c(SO42-)
D. V1 L④与V2 L②溶液混合后,若混合后溶液pH=4,则V1∶V2= 11∶9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com