
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 稳定性:PH3>H2S>HCl |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.氢化物都是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>Br>I,所以酸性:HClO4>HBrO4>HIO4,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确;
C.氢化物都是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高,HF中含有氢键,其熔沸点在其主族元素的氢化物中最高,所以沸点:HF>HBr>HCl,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以稳定性:PH3<H2S<HCl,故D错误;
故选D.
点评 本题考查元素周期律及氢键,为高频考点,明确元素金属性、非金属性与其最高价氧化物的水化物酸碱性的关系是解本题关键,易错选项是C,注意氢化物的稳定性有化学键有关,氢化物的熔沸点与分子间作用力和氢键有关,注意氢化物稳定性和熔沸点高低判断区别,为易错点.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
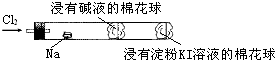
| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端棉球外颜色变化可判断氯气是否被碱液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 燃料电池的燃料都在负极发生氧化反应 | |
| D. | Fe3O4俗称铁红,常做红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B.乙烯
B.乙烯
 2NH3
2NH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 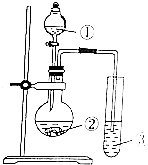 |
| A | 浓醋酸 | 石灰石 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 | |
| B | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| C | 稀硫酸 | FeS | SO2水溶液 | BaS可还原SO2 | |
| D | 盐浓酸 | 浓硫酸 | BaSO3悬浊液 | BaSO3可溶于盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氧化剂和还原剂的质量比为1:2 | |
| B. | 反应中生成了8g Cu2S | |
| C. | 反应中有0.2×6.02×1023个电子转移 | |
| D. | 反应中有1.6g硫被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com