


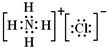 ,铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在极性共价键和配位键,故选:BD.
,铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在极性共价键和配位键,故选:BD.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 加热 |




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
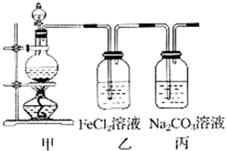 (2013?滨州一模)(1)某学习小组利用下图装置制取氯气并探究其性质.
(2013?滨州一模)(1)某学习小组利用下图装置制取氯气并探究其性质.
| ||
| ||
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 加入适量1mol/L的盐酸,塞上带导管的单孔塞,将导管的另一端插入A试管中 加入适量1mol/L的盐酸,塞上带导管的单孔塞,将导管的另一端插入A试管中 |
若无气体放出且澄清石灰水未见浑浊,则假设一成立; 若有气泡冒出,且澄清石灰水变浑浊则假设一步成立,假设二、三成立 若有气泡冒出,且澄清石灰水变浑浊则假设一步成立,假设二、三成立 |
| ② | 用胶头滴管向上述步骤后的B试管中滴入几滴品红试液,振荡 用胶头滴管向上述步骤后的B试管中滴入几滴品红试液,振荡 |
若品红溶液不褪色,则假设二成立,若品红溶液褪色,则假设三成立 若品红溶液不褪色,则假设二成立,若品红溶液褪色,则假设三成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com