
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 酒精灯内酒精不能多于酒精灯容积的2/3 | |
| C. | 实验结束后将试管清洗干净 | |
| D. | 胶头滴管不能交叉使用 |
分析 A.剩余药品不能放回原试剂瓶,是防止污染药品;
B.酒精灯内酒精太多容易引起爆炸;
C.相等试管目的是为了避免下次使用时污染其它试剂,影响实验结果;
D.胶头滴管不能交叉使用,目的是为了避免污染试剂.
解答 解:A.为了避免污染试剂,实验剩余的药品不能放回原试剂瓶,该目的不是从安全角度考虑,故A错误;
B.酒精灯内酒精太多,容易由于酒精的挥发形成蒸汽,从而引起爆炸,故B正确;
C.实验结束后将试管清洗干净,目的是避免污染试剂,干扰实验结果,不是从安全角度考虑,故C错误;
D.胶头滴管不能交叉使用,主要是为了避免污染试剂,不是从安全角度考虑,故D错误;
故选B.
点评 本题考查了常见的基本实验操作目的,题目难度不大,主要掌握基本实验操作方法,明确实验操作目的,试题培养了学生灵活应用所学知识的能力.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳通过灼热的氧化铁 | B. | 氧化铝溶于盐酸 | ||
| C. | 过氧化钠固体中通人水蒸气 | D. | 氢氧化亚铁露置在空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
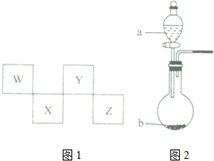 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.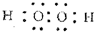 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
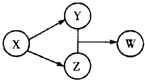 X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是 | A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al2O3 |
| Y | FeCl2 | NaOH | CO2 | AlCl3 |
| Z | Cl2 | Na2CO3 | CaCO3 | NaAlO2 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 3:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
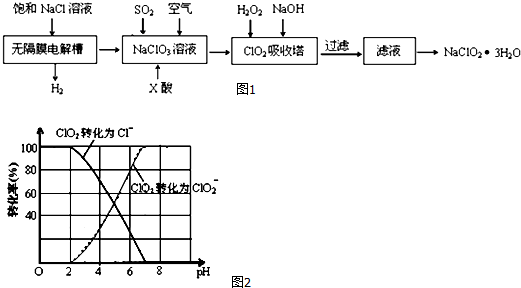
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| D. | C2H5OH(CH3COOH),加足量CaO,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+Cu2+=Fe2++Cu | B. | 2H2S+SO2=3S+2H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com