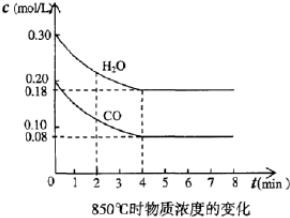
人们经常用电化学的基本理论和测定方法求算一些热力学函数变化值,或用已知的热力学函数值来求得电化学反应的物理量,这些理论和方法的应用给解决实际问题带来极大方便.
现设计以下电池(298K,p
Θ)
(-)(Pt)Cl
2(g,p
Θ)|HCl(1mol/dm
3)|AgCl(s)-Ag(s)(+)
其中Cl
-1|AgCl(s)-Ag(s)电极称为银-氯化银电极,是微溶盐电极,其电极反应为:AgCl(s)+e
-→Ag(s)+Cl
-(1mol/dm
3),是对Cl
-的可逆电极.
已知有关物质的热力学数据如下:
| 物质 | △fHΘm/kJ?mol-1 | SΘm/J?mol-1?K-1 |
| AgCl (s) | -127.0 | 96.11 |
| Ag (s) | 0 | 42.70 |
| Cl2 (g) | 0 | 223.0 |
法拉第常数 F=9.65×10
4 C?molˉ
1,理想气体常数R=8.314J?molˉ
1?Kˉ
1(1)根据该电池正、负极的电极反应,写出该电池的电池反应式
(2)求该反应的△
rH
Θm和△
rS
Θm和△
rG
Θm,(298K,p
Θ)
(3)求该电池反应的电动势E及标准电池电动势E
Θ.已知△
rG
Θm=-nFE
Θ;
△
rG=-nFE,其中n为电极反应得失电子的物质的量.
(4)求该电池在可逆放电时的热效应Q
R.Q
R等于该反应的△
rΗ
Θm吗?为什么?
(5)已知恒压下△
rS
Θm=nF(△E/△T),(△E/△T)为电池电动势的温度系数,试求之?
(6)求该电池反应的平衡常数K
Θ.
(7)根据题(3)中求得的E
Θ和E的数值,能否判断所设计的电池是自发电池还是非自发电池?若想改变方向,如何进行操作?

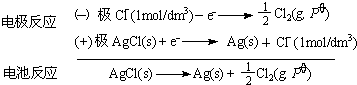 ,
,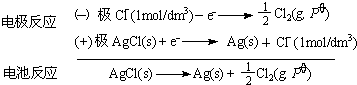 ;
;

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案 按要求回答下列问题.
按要求回答下列问题.