
下列反应属于非氧化还原反应的是( )
|
| A. | Fe2O3+3CO | B. | NH4NO3 |
|
| C. | CaCO3 | D. | 4CuO |
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸 雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子 质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol任何气体所含分子数都相同,体积也都约为22.4 L |
|
| B. | 1molKClO3和1molSO2中,所含氧原子的个数比为3:2 |
|
| C. | 物质的量就是物质的摩尔质量 |
|
| D. | 在非标准状况下,1 mol任何物质的体积都不是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
将下列物质按酸、碱、盐、氧化物分类排列,正确的是( )
|
| A. | 硫酸、纯碱、生石灰、氧气 | B. | 醋酸、烧碱、硝酸钾、干冰 |
|
| C. | NaHSO4、乙醇、CaCO3、水 | D. | 硝酸、熟石灰、苛性钠、甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明强酸性溶液中,能大量共存的离子组是( )
|
| A. | K+、Cu2+、NO3﹣、SO42﹣ | B. | K+、Na+、Cl﹣、CO32﹣ |
|
| C. | Zn2+、NH4+、NO3﹣、Cl﹣ | D. | K+、Na+、MnO4﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应中,氧化反应与还原反应在同种元素中进行的是( )
|
| A. | Cl2+2NaOH═NaCl+NaClO+H2O |
|
| B. | 2KClO3 |
|
| C. | 2KMnO4 |
|
| D. | 2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
|
| A. | KClO3在反应中得到电子 |
|
| B. | ClO2是氧化产物 |
|
| C. | H2C2O4在反应中被还原 |
|
| D. | 1mol KClO3参加反应有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 乙醇和乙酸都是常用调味品的主要成分 |
|
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 |
|
| C. | 乙醇和乙酸都能发生氧化反应 |
|
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
FeSO4是一种精细化工产品,可用于治疗缺铁性贫血、制革、木材防腐等。制备步骤:①将3mol·L-1硫酸加入铁粉里,微热,搅拌使其充分反应;②趁热过滤;③在50℃左右蒸发、结晶,得到晶体——绿矾(FeSO4·7H2O)。回答下列问题:
(1)制备FeSO4溶液时一般不用较浓硫酸而用3mol·L-1硫酸的原因是___________
________________________________________________________________,反应时要求铁粉过量的理由是____________________________________________。
(2)检验步骤①所得溶液中金属阳离子的方法是__________________________
_________________________________________________。
(3)步骤②趁热过滤的原因是___________________________________。
(4)在空气中加热绿矾,固体质量与温度变化曲线如下图: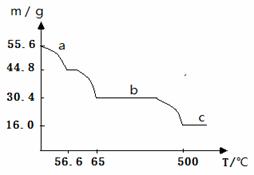
a曲线对应的反应化学方程式为___________________________________。
c曲线对应的物质化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com