
反应2HI(g) I2(g)+H2(g)在不同温度下的平衡常数
I2(g)+H2(g)在不同温度下的平衡常数
如右表所示,在所述温度中,HI的转化率最高的是
A.490℃ B.425℃ C.350℃ D.无法确定
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列叙述中不正确的是( )。
A、HClO4的酸性比H2SO4强 B、硫化氢的稳定性比氯化氢的强
C、钠与硫化合时生成硫化钠 D、氯气的氧化性比单质硫的强
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验:
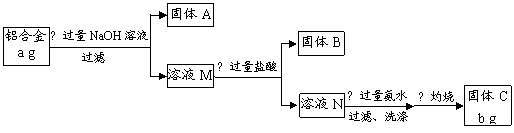 |
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ▲ ;
(2)生成固体B的离子方程式为 ▲ ;
步骤③中生成沉淀的离子方程式为 ▲ ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为 ▲
;
(4)该样品中铝的质量分数是 ▲ ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ▲ ;
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示装置进行实验,并回答下列问题:
|

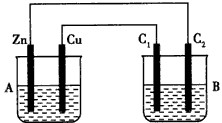

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;
铜极为________极,电极反应式为________________________ ;
石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言来描述,下列有关化学用语错误的是
A.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH-
B.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2 e-=Cu
C.用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:
2C1-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D.钢铁发生电化学腐蚀的负极反应式:Fe一2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时每转移6 mol电子,正极有2 mol K2FeO4被氧化
B.放电时负极附近溶液的碱性增强
C.放电时负极反应为:Zn-2e-+2OH- =Zn(OH)2
D.充电时阳极反应为:Fe(OH)3-3e-+5OH- =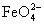 +4H2O
+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
 (1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
①从反应开始到3 min时,氢气的平均反应速率v(H2)=________。
②下列措施中一定能使CO2的转化率增 大的是_______。
大的是_______。
A.在原容器中再充入1 mol H2
B.在原容器中再充入1 mol CO2
C.缩小容器的容积
D.使用更有效的催化剂
E.在原容器中充入1 mol He
F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。
请根据表中数据回答下列问题。
|
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③增大的值,则生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能
确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
A. KCl中含有35Cl
B. 生成物Cl2的相对分子质量为73.3
C.该反应转移的电子数为6e-
D.氧化剂和还原剂的物质的量之比为1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.乙烯和丙烯组成的42 g混合气体中氢原子的个数为6 NA
C.1 mol Na2O2固体中含离子总数为4NA
D.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com