
【题目】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式![]() 电子排布图
电子排布图![]() 为__,基态镍原子中核外电子占据最高能层的符号为__。
为__,基态镍原子中核外电子占据最高能层的符号为__。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为__晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为__,写出与配体互为等电子体的阴离子__![]() 任写一种
任写一种![]() 。
。
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱__>__![]() 填化学式
填化学式![]() ,理由是__。
,理由是__。
(4)H2S的键角__填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由__。
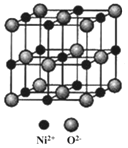
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的__空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为__g/cm3(只列出计算式![]() 。
。
【答案】![]() N 分子晶体 sp3杂化 CN-或C22- H2SeO4 H2SeO3 因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离 小于 由于氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大 正八面体
N 分子晶体 sp3杂化 CN-或C22- H2SeO4 H2SeO3 因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离 小于 由于氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大 正八面体 ![]()
【解析】
(1)原子的能层越高,其能量越大;
(2)分子晶体是通过分子间作用力构成的晶体;原子数相同,电子总数相同的分子或离子互称等电子体;
(3)无机含氧酸中的非羟基氧的数目越多,其酸性越强;
(4)在同主族元素中,由上到下原子的非金属性是逐渐增强的,电负性是逐渐增大的。
(1)S位于周期表中第3周期第VIA族,基态硫原子的价电子排布式为3s23p4,则基态硫原子价层电的轨道表达式(电子排布图)为:![]() ;Ni位于周期表中第4周期,所以基态Ni的核外电子占据的最高能层为N,
;Ni位于周期表中第4周期,所以基态Ni的核外电子占据的最高能层为N,
(2)根据相似相溶原理判断,Ni(CO)4溶于乙醇、CCl4、苯等有机溶剂,所以可判断Ni(CO)4为分子体,Ni(CO)4空间构型与甲烷相同,甲烷为正四面体,中心C原子为sp3杂化,所以可判断其中心原子的杂化轨道类型为sp3;等电子体是指原子总数相同,价电子总数相同的微粒,CO的原子数为2,其价电子数为14,所以其等电子体可以为CN-或C22-;
(3)与硫同族的硒元素有两种常见的二元含氧酸,分别为H2SeO4和H2SeO3,因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离;
(4)根据价层电子对互斥理论,孤电子对存在可使键角变小,电负性O大于S,故氧原子对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大;
(5)根据晶胞结构分析,阴离子采取面心立方堆积,形成八面体空隙和四面体空隙,但Ni2+填充八面体空隙,由于阴离子是面心立方堆积,所以晶胞边长为a=2r(Ni2+) +2r(O2-)=418nm,设取1mol晶胞,即有NA个晶胞,则晶体密度为![]() =
=![]() 。
。
。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3 L的某密闭容器中加入1 mol A、2 mol B,一定温度下发生如下反应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
A. 5 min内D的平均反应速率为0.02 mol·L-1·min-1
B. 5 min内A的平均反应速率为0.06 mol·L-1·min-1
C. 经5 min后,向容器内再加入C,正反应速率变小
D. 平衡状态时,生成1 mol D时同时生成1 mol A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
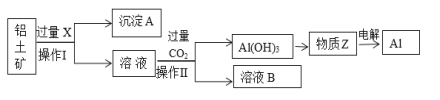
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:____________。
(3)沉淀A的主要成分是________,溶液B中的成分为:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
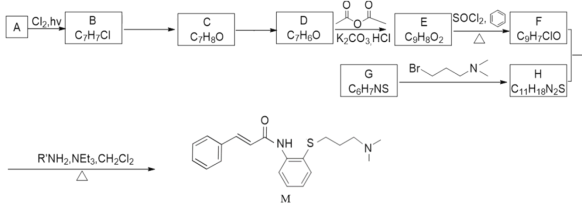
【题目】科学家研究发现药物肉桂硫胺(M)可能对2019-nCoV有效,是抗击新型冠状病毒潜在用药,以芳香烃A为原料,合成肉桂硫胺路线如图:
已知: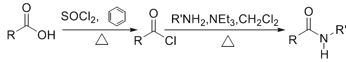
回答下列问题:
(1)A的名称为___。B→C的试剂和条件为__。
(2)C中含有的官能团名称为__。
(3)有机物D与新制的Cu(OH)2悬浊液加热煮沸产生砖红色沉淀的化学方程式是__。
(4)E反式结构简式为__,F最多有__个原子共平面。
(5)G→H的化学方程式为__,G→H的反应类型为__。
(6)J是E的同分异构体,满足下列条件的J的结构有___种;
①J能与溴水发生加成反应②J水解产物遇到FeCl3溶液显紫色
其中苯环上有两种化学环境的氢的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命,它的分子式为C15H22O5。NA表示阿伏伽德罗常数,下列关于青蒿素的说法不正确的是( )
A.青蒿素的摩尔质量等于282![]() B.14.1g青蒿素中含氧原子数目为0.05NA
B.14.1g青蒿素中含氧原子数目为0.05NA
C.1mol青蒿素完全燃烧,生成11NA个H2OD.10g青蒿素中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1L未知成分的混合溶液,其中除了含有0.2mol/L的Na+外,还可能含有下列离子中的一种或几种:
![]()
现进行如下实验操作(每次实验所加试剂均过量):
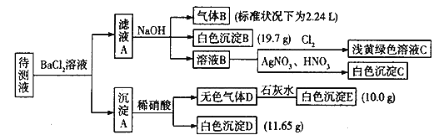
已知:①![]() ,②
,②![]() ,Cl2在常温下为黄绿色气体,可溶于水,其水溶液为浅黄绿色;Br2在常温下是深红棕色液体,微溶于水,其水溶液为黄色。
,Cl2在常温下为黄绿色气体,可溶于水,其水溶液为浅黄绿色;Br2在常温下是深红棕色液体,微溶于水,其水溶液为黄色。
(1)由气体B可确定待测液中含有的离子是____________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有_____离子,据此可以排除的离子是_____。
(3)由白色沉淀B可确定待测液中含有的离子是____,写出产生沉淀B的离子方程式_______。
(4)某同学读图后,认为待测液中一定不含Br—,他的判断依据是______。
(5)综合分析,待测液中![]() 的物质的量浓度的取值范围为________。
的物质的量浓度的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)![]() 泄漏会导致人体中毒,用于检测
泄漏会导致人体中毒,用于检测![]() 的传感器的工作原理如图所示:
的传感器的工作原理如图所示:

①写出电极Ⅰ上发生的反应式:__________
②工作一段时间后溶液中![]() 的浓度__________(填“变大”、“变小”或“不变”)
的浓度__________(填“变大”、“变小”或“不变”)
(2)用![]() 氧化
氧化![]() 制取
制取![]() ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:![]() ,通过控制条件,分两步循环进行,可使
,通过控制条件,分两步循环进行,可使![]() 转化率接近100%,其原理如图所示:
转化率接近100%,其原理如图所示:

过程Ⅰ的反应为:![]()
过程Ⅱ反应的热化学方程式(![]() 用含有
用含有![]() 和
和![]() 的代数式表示)__________。
的代数式表示)__________。
(3)在温度![]() ,容积为
,容积为![]() 的绝热容器中,充入
的绝热容器中,充入![]() ,发生反应:
,发生反应:![]() ,容器中
,容器中![]() 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。

①反应到![]() 时,
时,![]() 的转化率是__________。
的转化率是__________。
②根据图示,以下各点表示反应达到平衡状态的是________。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
③![]() 内容器中
内容器中![]() 的反应速率增大,而
的反应速率增大,而![]() 后容器中
后容器中![]() 的反应速率减小了,原因是_______。
的反应速率减小了,原因是_______。
④此容器中反应达平衡时,温度若为![]() ,此温度下的平衡常数
,此温度下的平衡常数![]() =__________。
=__________。
(4)工业上可用![]() 溶液吸收法处理
溶液吸收法处理![]() ,25℃时用
,25℃时用![]() 的
的![]() 溶液吸收
溶液吸收![]() ,当溶液
,当溶液![]() 时,溶液中各离子浓度的大小关系为:
时,溶液中各离子浓度的大小关系为:![]() 。(已知25℃时:
。(已知25℃时:![]() 的电离常数
的电离常数![]() ,
,![]() )请结合所学理论通过计算说明
)请结合所学理论通过计算说明![]() 的原因__________。
的原因__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com