
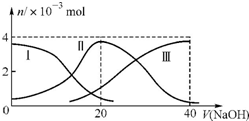
 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )| A. | 曲线Ⅱ代表的粒子是HC2O4- | |
| B. | 当V(NaOH)=20ml时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | NaH C2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| D. | 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液PH可能逐渐减小 |
分析 A、依据图象分析各自代表的物质即可;
B、根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2C2O4═NaHC2O4+H2O,溶液主要为NaH2C2O4,电离为主,溶液显酸性;
C、根据质子守恒分析;
D、溶液中存在电离平衡:HC2O4-?C2O42-+H+,CaCl2粉末生成CaC2O4沉淀,根据平衡移动分析.
解答 解:A、据题意知图中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,故A正确;
B、根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2C2O4═NaHC2O4+H2O,溶液主要为NaH2C2O4,电离为主,HC2O4-电离程度大于水解程度,则c(H+)>c(C2O42-),则溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故B错误;
C、NaH C2O4溶液中存在质子守恒:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4),故C正确;
D、溶液中存在电离平衡:HC2O4-?C2O42-+H+,CaCl2粉末生成CaC2O4沉淀,电离平衡正移,则c(H+)增大,溶液PH可能逐渐减小,故D正确.
故选B.
点评 本题考查酸碱混合溶液定性判断,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
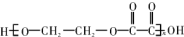 ,以下叙述错误的是( )
,以下叙述错误的是( )| A. | A属于醛类 | |
| B. | A有相对分子质量为58 | |
| C. | A分子中有6个原子含C 40% | |
| D. | 1molA与足量银氨溶液反应还原出4molAg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时正极反应为:FeO${\;}_{4}^{2-}$+4H2O+3e-═Fe(OH)3+5OH- | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$amol | |
| B. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$ | |
| C. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤amol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com