
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:分析 ①达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
②化学反应的平衡常数随着温度的变化而变化;
③根据化学反应三行式来计算转化率和平衡常数.
解答 解:A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故C错误;
D.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故D正确.
故选D;
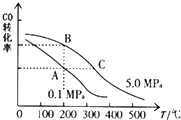
②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,故答案为:=;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率$\frac{0.75}{1}$×100%=75%,此温度下的化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•c({H}_{2})^{3}}$=$\frac{0.75}{0.25×1.{5}^{2}}$≈1.3,故答案为:75%,1.3.
点评 本题考查化学平衡状态的判断、化学反应速率以及化学平衡常数、转化率是现在考试的热点,注意三行式在计算中的应用,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | 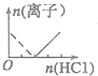 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
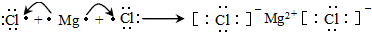 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ②⑤⑦⑧ | C. | ①③⑤⑥ | D. | ②⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 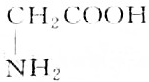 | B. | 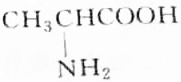 | ||
| C. | 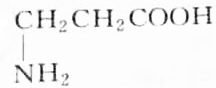 | D. | 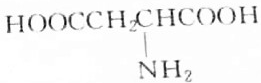 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍、镁、钙、锶、钡等碱土金属元素,在自然界都以化合态存在 | |
| B. | 从元素周期表知道,现在已经发现了113种原子 | |
| C. | 室温时,0族元素的单质都是气体 | |
| D. | 第三周期的主族元素原子的最高正价数与原子最外层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

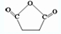 .
. )外的名称是酯基,C→D的反应类型为取代反应.
)外的名称是酯基,C→D的反应类型为取代反应. (任写一个).
(任写一个).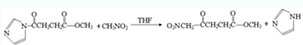 .
. ,请根据本题的所有信息设计由CH3CH2COOH、苯为原料合成单体
,请根据本题的所有信息设计由CH3CH2COOH、苯为原料合成单体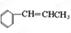 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)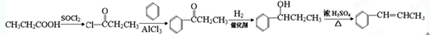 .合成路线流程图示例如下:HC2=CH2$\stackrel{HBr}{→}$CH3CH2$→_{△}^{NaOH溶液}$CH3CH2OH.
.合成路线流程图示例如下:HC2=CH2$\stackrel{HBr}{→}$CH3CH2$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com