
 实验室制硝基苯的装置见如图
实验室制硝基苯的装置见如图 .
.分析 (1)苯与浓硝酸在浓H2SO4作催化剂和脱水剂、加热条件下反应生成硝基苯与水;
(2)由于苯和硝酸有挥发性,冷凝苯和硝酸作用;
(3)取出反应物中不溶于水的只有苯和硝基苯,而苯比水轻,硝基苯比水重,所以会沉下来;
(4)硝酸不稳定,分解得到二氧化氮,硝基苯溶解二氧化氮显黄色;硝基苯与水溶液不互溶,采取分液的方法分离.
解答 解:(1)实验室用浓硝酸和苯在浓硫酸作用下制备硝基苯,反应的化学方程式为 ,
,
故答案为: ;
;
(2)苯和硝酸沸点较低,易挥发,可用长玻璃导管冷凝回流,故答案为:冷凝回流;
(3)取出反应物中不溶于水的只有苯和硝基苯,苯比水轻,硝基苯的密度比水大,且不溶于水,当观察到油珠下沉,说明有硝基苯生成,
故答案为:硝基苯和苯都比混合酸轻,但硝基苯比水重、苯比水轻且都不溶于水,所以若油珠下沉,说明有硝基苯生成;
(4)硝酸不稳定,分解得到二氧化氮,硝基苯溶解二氧化氮显黄色;粗硝基苯与水溶液不互溶,采取分液的方法分离,实验仪器为分液漏斗,
故答案为:溶解NO2;分液漏斗.
点评 本题考查溴苯的制备,比较简单,要熟知有机物的化学性质以及物理性质.


科目:高中化学 来源: 题型:选择题
| A. | 正丁烷的稳定性大于异丁烷 | |
| B. | 异丁烷分子中的碳氢键比正丁烷的多 | |
| C. | 等物质的量的正丁烷能量大于异丁烷能量 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
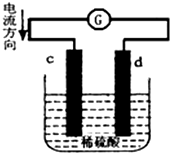 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )| A. | 当电路中通过2 mol 电子时,d 极可以生成22.4 L H2 | |
| B. | 当电路中通过0.1 mol 电子时,溶液中c(Zn2+)=0.5 mol•L-1 | |
| C. | c为负极,发生氧化反应 | |
| D. | 电池工作完成后,溶液中SO42-浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部贮存着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能贮存起来 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能为人类所利用 | |
| D. | 吸热反应中由于反应物的总能量小于生成物的总能量,因而没有利用价值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
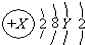 .则下列说法正确的是( )
.则下列说法正确的是( )| A. | 3p能级上的电子数只能为6 | |
| B. | 3d能级上的电子数可能为1-10 | |
| C. | Y可只能为3-8 | |
| D. | 2p,3p能级上的电子数可以相同,也可以不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| B. | 标准状况下22.4升CH4和C2H4的混合气体所含氢原子数为4NA28bNA | |
| C. | 常温常压下,3.4gNH3中含N-H键数目为0.6NA | |
| D. | CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/LH2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | - |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/LKMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠和盐酸溶于水都发生电离,克服粒子间作用力的类型相同 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | HI的分子质量大于HF,所以HI的沸点高于HF | |
| D. | 由IA族和VIA族元素形成的原子个数比为l:1,离子个数比为2:l的化合物是含有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ① | C. | ①④ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com