
【题目】中国自古有“信口雌黄”、“雄黄入药”之说。雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。根据题意完成下列填空:
(1) 砷元素有+2、+3两种常见价态。As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,写出该反应的化学方程式_____________________。
(2) 上述反应中的氧化剂是___________;氧化产物是___________;反应产生的H2S气体可用____________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++ 10NO3—=2H3AsO4+3S+10NO2↑+ 2H2O。若生成1mol H3AsO4,则反应中转移电子的物质的量为___________;若将该反应设计成一原电池,则NO2应该在___________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,写出碳与浓硝酸反应的化学方程式__________________;所产生的CO2的量___________(选填编号)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确定
【答案】(1)2As2S3+2SnCl2+4HCl==As4S4+2SnCl4+2H2S↑(2分)
(2)As2S3(1分);SnCl4(1分);NaOH溶液或CuSO4溶液(1分)(3)5mol(1分);正极(1分)
(4)C+4HNO3(浓![]() CO2↑+4NO2↑+2H2O(2分);A(1分)
CO2↑+4NO2↑+2H2O(2分);A(1分)
【解析】
试题分析:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;
(2)因在该反应中As2S3中As元素的化合价降低,则As2S3为氧化剂;SnCl2是还原剂,则SnCl4是氧化产物;H2S为酸性气体,可用NaOH溶液吸收,硫化铜不溶于酸,也可以硫酸铜溶液吸收;
(3)反应As2S3+10H++ 10NO3—=2H3AsO4+3S+10NO2↑+ 2H2O中,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,若生成1mol H3AsO4,转移电子数为1mol×(5-3)+3mol×(0+2)=5mol;N元素化合价由+5降低为+4,反应中NO3-发生还原反应生成NO2,则NO2在正极析出;
(4)碳与浓硝酸反应的化学方程式为C+4HNO3(浓![]() CO2↑+4NO2↑+2H2O;由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,浓硝酸与碳反应生成二氧化碳与二氧化氮,若反应得到硝酸能与碳完全反应,纵观整个过程,氧气获得电子等于碳失去电子,氧气的物质的量为11.2L÷22.4L/mol=0.5mol,根据电子转移守恒,反应碳的物质的量为0.5mol×4/4=0.5mol,但随着反应到进行,硝酸的浓度会降低,而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,答案选A。
CO2↑+4NO2↑+2H2O;由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,浓硝酸与碳反应生成二氧化碳与二氧化氮,若反应得到硝酸能与碳完全反应,纵观整个过程,氧气获得电子等于碳失去电子,氧气的物质的量为11.2L÷22.4L/mol=0.5mol,根据电子转移守恒,反应碳的物质的量为0.5mol×4/4=0.5mol,但随着反应到进行,硝酸的浓度会降低,而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,答案选A。


科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途,清根据要求完成下列各题。
I.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。

(1)用装置A制备氨气时,检验a处是否有氨气产生的方法是____________。
(2)制取(NH4)2SO4溶液时仪器连接的顺序(用接口序号字母表示)是:a → _____________。
(3)将装置C中两种液体分离所需的玻璃仪器是 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
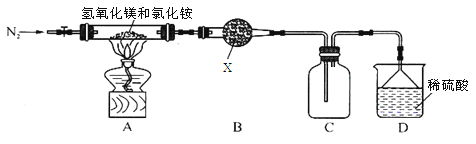
(4)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(5)装置B中试剂X为________________。
(6)上述装置图中的一处错误是______________。
(7)MgCl2·6H2O在空气中加热,生成Mg(OH)Cl,若由MgCl2·6H2O制备无水MgCl2,应_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)需要量取浓盐酸_________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外, 还必须用到的仪器有 、 。
(3)若实验遇到下列情况,所配溶液的浓度会(填“偏高”、“偏低”、“不变”)
A、定容时仰视刻度线_________;
B、容量瓶内壁附有水珠而未干燥处理______ ;
C、溶解后没有冷却便进行定容_____ 。
(4)将所配制的稀盐酸倒入5.92g Na2CO3和NaHCO3的固体混合物中,恰好完全反应,则原混合物中Na2CO3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识正确的是( )
A. 甲烷、苯都不能发生氧化反应
B. 乙烯、聚乙烯都可与溴水发生加成反应
C. 一氯丙烷(C3H7Cl)的同分异构体共有3种
D. 乙酸乙酯、油脂与NaOH溶液反应均有醇类物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24 mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2价 B.+3价 C.+4价 D.+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的,它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是
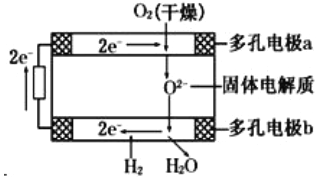
A.有O2放电的a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为2H2- 4e-+2O2-=2H2O
D.a极对应的电极反应为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是( )
A. 由上述热化学方程式可知b>c
B. 甲烷的燃烧热为bkJ/mol
C. 2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ mol一1
D. 当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。
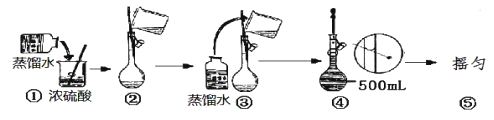
(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com