
分析 (1)依据配制溶液的体积结合容量瓶规格选择合适的容量瓶,依据m=CVM计算需要溶质的质量;
(2)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差判断;
解答 解:(1)配制480mL 0.4mol/L 的NaOH溶液,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.4mol/L×0.5L×40g/mol=8.0g;
故答案为:8.0;
(2)A.定容时观察液面俯视,导致溶液体积偏小,溶液浓度偏高,故A选;
B.定容时液面超过刻度线用胶头滴管吸出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B选;
C.有少量NaOH溶液残留在烧杯中,导致溶质的物质的量偏小,溶液浓度偏低,故C选;
D.容量瓶中原来有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故D不选;
故选:BC.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确物质的量浓度有关计算,熟悉依据C=$\frac{n}{V}$进行误差判断的方法是解题关键,题目难度不大.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:填空题
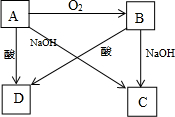
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCLO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
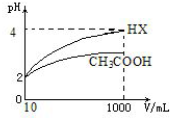
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
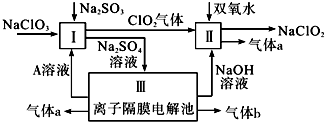
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
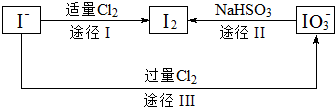
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同的条件下,白磷比红磷稳定 | |
| B. | 红磷容易发生自燃而白磷则不会 | |
| C. | 红磷和白磷的结构相同 | |
| D. | 自在相同的条件下,红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无气味 | B. | 能溶于水 | C. | 能与水反应 | D. | 能与铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(4) | B. | (4)(3) | C. | (1)(2) | D. | (2)(3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com