
分析 给出八种离子形成四种可溶性盐,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定,如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
解答 解:(1)由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-,Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3;由于C盐是蓝色的,所以A为CuSO4;四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;D生成无色气体,则为二氧化碳,即D为Na2CO3,所以A为BaCl2,
故答案为:BaCl2;CuSO4;
(2)若向①的四支试管中分别加盐酸,B盐溶液有沉淀产生,B溶液为AgNO3,即Ag++Cl-=AgCl↓;D盐溶液有无色无味气体逸出,D为Na2CO3,即CO32-+2H+=CO2↑+H2O;
故答案为:Ag++Cl-=AgCl↓;CO32-+2H+=CO2↑+H2O.
点评 多种离子的物质构成首先根据限制条件推断可能的物质存在,进一步通过实验来进行物质的对应关系的确认,注意离子的检验知识的应用是关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 299 | B. | 598 | C. | 587 | D. | 447 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
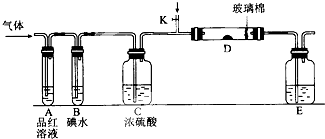 某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


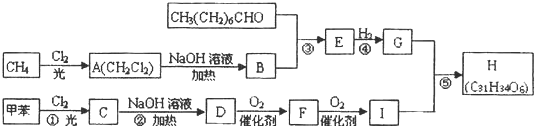
 ,F
,F .
. 、
、 、
、 、
、 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com