
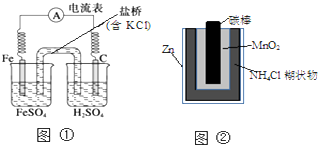
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
分析 A、正极的电极反应式为:2H++2e-=H2↑,氢离子浓度减小;
B、正极材料为MnO2,发生还原反应,电极反应式为2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O;
C、电子由负极流向正极,阴离子向负极移动;
D、氯化铵溶液显酸性,锌在酸性环境中容易失电子,表现出还原性.
解答 解:A、正极的电极反应式为:2H++2e-=H2↑,氢离子浓度减小,附近溶液pH增大,故A错误;
B、正极材料为MnO2,发生还原反应,电极反应式为2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O,故B错误;
C、电子由负极流向正极,所以电子由Fe流向石墨,阴离子向负极移动,即FeSO4溶液,故C正确;
D、该原电池中锌作负极,负极上失电子发生氧化反应,所以Zn-MnO2干电池自放电腐蚀主要是由Zn的还原作用引起的,故D错误;
故选C.
点评 本题考查原电池的组成和工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意电极的组成和电极反应式以及总反应式的书写.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
2015年10月,科学家屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284。下列关于双氢青蒿素的说法正确的是( )
A.3.01×1023个双氢青蒿素的质量为142 g·mol-1
B.双氢青蒿素中的C、H、O三种元素的质量比45∶6∶20
C.7.1 g双氢青蒿素中含有的氢原子总数为1.2NA
D.含有NA个碳原子的双氢青蒿素的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li为电池的负极 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经外电路流向正极 | |
| D. | 充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓盐酸与二氧化锰共热制氯气 | |
| B. | 标准状况下,将1 g铝片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
分子式为C4H8Cl2的同分异构体有( )
A.3种 B.5种 C.8种 D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水鉴别二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鉴别FeCl2和Fe2(SO4)3 | |
| C. | 用冷却热饱和溶液的方法鉴别NaCl溶液和KNO3溶液 | |
| D. | 用燃着的木条鉴别N2,H2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一段时间后Zn电极逐渐溶解 | |
| B. | 该装置中Cu极为正极,发生还原反应 | |
| C. | b极反应的电极反应式为:H2-2e-=2H+ | |
| D. | 电流方向:a电极→ →Cu电极 →Cu电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com